
X-Ray Crystal Structure Analysis of Bovine Heart Cytochrome c Oxidase
Institute for Protein Research, Osaka University, Tomitake Tsukihara
Three dimensional structure of the metal centers of bovine heart cytochrome c oxidase has been determined at 2.8 A resolution by X-ray crystal structure analysis at 2.8 A resolution. CuA site exhibits an unexpected structure with a dinuclear center of [2Cu-2SY]. There is no amino acid residue bridging Fea3 and CuB in spite of strong magnetic coupling between two metal centers. CuB is coordinated by three His residues. Heme a and a3 are linked by a polypeptide segment consisting of three residues. There exists no direct contact between two hemes.
1. はじめに
ウシ心筋のチトクロムc酸化酵素は、呼吸鎖の末端で酸素を水に還元して細胞内に エネルギーを蓄える役割を持っている。13種のサブユニットからなる分子量が約2 0万の膜タンパク質である。この一連の反応には4ケ所の活性中心、CuA, CuB, ヘム a、ヘムa3が関与しており、ヘムa3とCuBの部位で酸素の還元が行われる。その他に 金属中心としては亜鉛やマグネシウムを含んでいる。酸素の還元には4電子必要であ りそれらは膜間側に存在するチトクロムcからCuAとヘムaを経てヘムa3に供給される と言われている。酸素の水への還元に必要なプロトンは膜のマトリックス側から取り 込まれる。さらにこの酸素還元反応に同期して数個のプロトンがマトリックス側から 膜間側にこの酵素内部を通って輸送される。その結果膜の両側でプロトン濃度勾配が 作られて、この濃度勾配がATP合成の駆動力になる。これらの機構を原子のレベルで 解明するためにx線結晶構造解析を行っている。このたびは酸化型の結晶構造を2.8Å 分解能で解析することに成功した(1)ので、構造決定の概要金属中心の構造について 述べる。
2. 結晶構造解析
結晶は斜方晶系で、空間群はP212121、格子定数はa=189.1Å,b=210.5Å,c=178.6Å である。高エネルギー物理学研究所の放射光をX線源として、巨大分子用ワイセンベ ルグカメラ(2)を使用して回折強度測定を行った。使用した波長は1.0Åで、振動幅1.0 °。振動領域の重なり0°の振動法を採用した。回折強度処理はDENZO(3)、ポストリフ アインメントはSCALEPACK(3)、ローカルスケーリングには我々自身のプログラムを 使用して行った。
200以上の条件について重原子誘導体の検索を行った結果、3種の条件で同型置 換体を得ることができた。Ir誘導体は重原子修飾の際の重原子濃度を変えることによ って異なった誘導体を得ることができた。重原子修飾による回折強度の変化率は決し で大きくないが、差のパターソン関数は重原子位置について明瞭な解を与えた。 重原子パラメーターの精密化はMLPHARE(4)を用いて行った。精密化の指標となる R Cullisは高く、位相決定の有効性の目安となるPhasing Powerは小さく、決定された 位相の信頼度の指標であるFigure of meritも5Å分解能でも0.5以下であった。低い Figure of meritにもかかわらず5Å分解能の電子密度図には明瞭な56本のαヘリッ クスが林立する構造が見つかった。
当初、格子定数と分子量から非対称単位中の分子数を4と想定し、位相決定には非 結晶学的対称(NCS)による平均法(5)を主力にしようと考えていた。しかし、得られた 電子密度図から2分子で、溶媒領域が72%を占めた。プログラムパッケージCCP4 のDMを使用して溶媒領域の平滑化(6)による位相の精密化を行った。溶媒領域の平滑 化による位相の精密化は、5Å分解能から初めて200サイクルの繰り返しによって2.8 Å分解能まで位相を拡張した。全体の反射の5%を使って求めたRfree、は0.53から0.28に順調に低下した。この段階で非結晶学的対称で関係づけられる2分子の電子密度の相関係数を求めたところ0.78と十分高い値を示した。そこで、位相の精密化にNCS平 均法も取り込んで再度5Å分解能から2.8Å分解能まで位相の拡張を行ったところ、 R丘eeは0・26と十分良い値になった。
バイフット差のフーリェ合成の計算に先立ってNativeデータはローカルスケーリン グによって補正を施した。バイフット差のフーリエ合成の実質的な分解能は4.5Åで あった。電子密度図はきわめて明瞭で主鎖のカルボニルやチロシンの酸素のふくらみ もはっきりと現われており、モノマー当たり約1800残基中の20残基以外は容易 に同定できた。その結果、モノマーを構成している13種すべてのサブユニットを確 定することができた。表1は電子密度分布とバイフット差のフーリエの高いピークを 拾い出したものである。電子密度で高い5ヵ所はすべてバイフット差のフーリエでも 高い値を示している。電子密度で次に高い値を示したピークはバイフット差のフーリ エ図ではノイズの高さに隠れてしまったことから、隣脂質の燐酸基と同定した。Zn, CuB, Fea, Fea3に対応するピークは両者の図においてきわめて合理的な値を示している。しかし、CuAのピーク値が双方において最も高い値を示したのは、CuA部位が2核の Cuによって構成されるとすれば合理的に説明がつき、配位構造の妥当性も考慮して CuA部位の構造を決定することができた。ヘムa, ヘムa3, CuB部位、Zn中心も電子密 度図に基づいて容易に分子モデルを作ることができた。

3. 全体の構造
この酵素は2量体を形成していて、その単量体は120x60x130Åの偏平な形 状をしている。単量体中には生化学的研究によって決められていた13種の異なった サブユニットがすべて存在し、それ以外の蛋白質サブユニットは存在しなかった。こ のサブユニット数は電気泳動法を駆使して決定された結果であり、この数を確認でき たことも大きな成果であった。膜貫通部分は疎水性アミノ酸残基の配置に基づいて決 定した。膜貫通部分の厚さは約50Åである。膜の方向は生化学的に決められていた ポリペプチドの末端部分の配置に合わすことによって決定した。これはチトクロム酸 化酵素のモデルとして教科書などで広く使われている電子顕微鏡によって決定された 2本足を持った歯形モデルとは形状も膜外の部分の大きさも異なっている。
この酵素の活性中心を含む中核部分は3種のサブユニットで構成されており、細菌 のチトクロム酸化酵素(7)も同じ構造をしている。中核部は、すべてミトコンドリ アで合成されたタンパク質で構成されており、膜に垂直な21本のヘリックスになっ ている。そのうちサブユニットIは12本、サブユニットIIは7本、サブユニットIIIは 2本の膜貫通ヘリックスをもっている。このミトコンドリア由来のサブユニットの周 囲を核のDNAにゴードされた10種のサブユニットが取り囲んでいる。このミトコン ドリア由来のタンパク質と核由来のタンパク質の配置は、分子進化の過程が分子の4 次構造形成の階層に見事に反映されていることを示している。
核由来のサブユニットのうちの7種はそれぞれ1本ずつ膜貫通ヘリックスを持って いる。残りの3種はすべて膜外にあるサブユニットであり、そのうち2種はマトリク ス側に、1分子は膜間側にある。モノマー全体では28本の膜貫通ヘリックスがある。 膜貫通部分ではヘリックス間のループ以外はほとんどヘリックスであり、それ以外の 構造はサブユニットIのCuBに配位している領域の数残基とサブユニットVIaのアミノ 戸末端部分の10残基程度しかない。
4. 金属中心の構造
図1はZn以外の金属中心の構造を示したものである。2つのヘム及びCuB部位はサ ブユニットIの中に、CuAはサブユニットIIの中に、MgはサブユニットIとサブユニッ トIIの間に保持されている。2つのヘム面は共に膜面に垂直で互いの面のなす角度は 約104度である。ヘムaの第5、第6配位子はともにHisである。長い鎖状のヒドロ キシファネシルエチル基はヘリックス間で、ヘリックスと平行な方向に延びている。 この鎖状構造あるいはヘムa3のそれがが2つのヘムの間を橋渡しする役割を担ってい るという考えもあったが、この構造と後で述べるヘムa3の構造によって完全に否定さ れた。
ヘムa3の第5配位子はHis376である。一方、CuBにはHis240, His290, His291の3 つのHisのイミダゾールが配位している。ヘムa3の鉄原子とcuBとの間は約4.5Åで、 銅原子はヘム面に投影した位置で鉄原子から約1Åずれた位置にある。両者の間には 強い磁気的相互作用があるあるにも関わらず、両者を橋渡しするアミノ酸側鎖は存在 しなっかた。しかし、水のような小さな分子が橋渡しをしている可能性はまだ否定で きない。
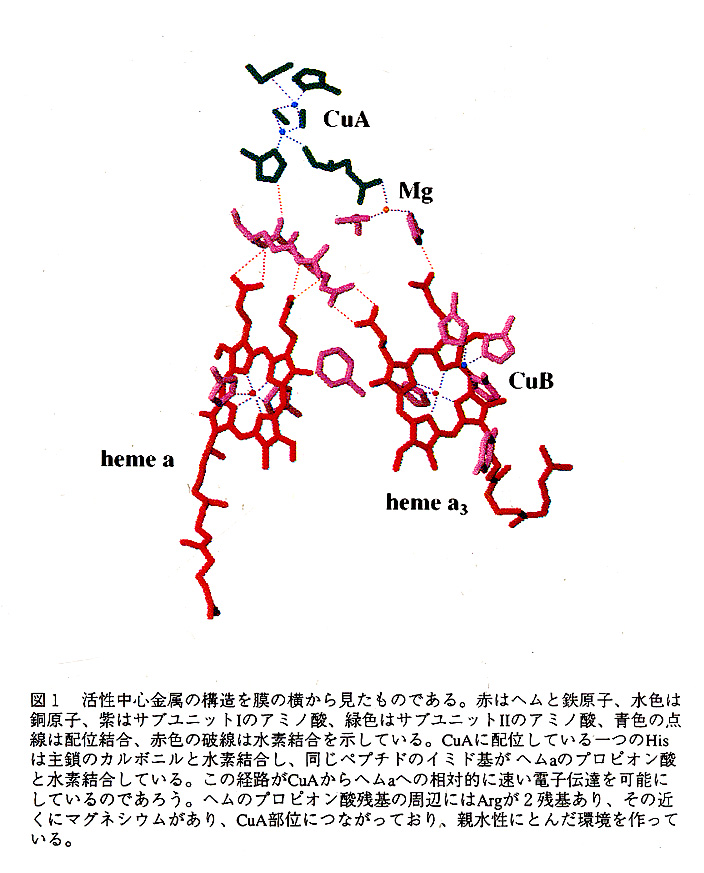
CuBに配位したHis240はTyr244と相互作用できる位置にあり、このTyr244はそのフ ェノールのOHでヘムa3のヒドロキシファネシルエチル基の0Hと水素結合している。 このつながりはFea3-CuB活性中心での反応に伴う立体構造の変化を伝播する役割だけ でなく、ヘムa3からCuBへの電子伝達のバイパス的役割も果たすのではないかと考え ている。ヘムa3のフォルミル基の酸素はHis290のイミダゾールから3.0Å上にあり、 このフォルミル基を介したヘムa3からCuBへの電子伝達も考慮すべきであろう。先の Tyr2ψについてはPheに置換すると立体構造ができあがらない(8)ことから構造形成 にも重要な役割を果たしていると思われる。
ヘムa3の第5配位子であるHis376はG1y351の主鎖のカルボニルと水素結合しており、 ヘムa側での構造変化がタンパク質側に伝わりやすくなっている。CuBの配位子であ るHis291のイミダゾール環はTrp236のインドール環とπ一π相互作用をしており、この 相互作用は機能と深く関わりがあるであろう。
ヒドロキシファネシルエチル基はヘムaとは相互作用できる構造にはなっていなく、 ヘムaのそれとは異なって折れ曲がった構造をしており、分子の表面にまで達して膜 の脂質に接触できる状態にある。このヒドロキシファネシルエチル基はヘムaのそれ と同様にヘムをタンパク質に固定する錨の役割もあろうが、脂質と接触することによ って酸素分子チャネルなどの機能に関係があるものと思われる。
酸素がヘムa3とCuBの間で水に還元されるときには4電子消費される。そのときに ヘムaとa3の間では電子のやり取りがあるのでそれに見合った構造が存在するはずで ある。しかし、両者で直接相互作用できる位置関係にある所はまったくない。最も近 いところでも4.5Å以上離れており、それもプロピオン酸どうしの酸素と炭素である。 電子伝達の経路としてはヘムaの配位子であるHis378から主鎖を介して2残基先のへ ムa3に配位しているHis376に至る経路と、同じHis378から隣のPhe377の芳香環を介し てヘムa3のピロール環に至る経路がある。最も可能性の高いのは前者の主鎖を介した 経路であろう。しかし、主鎖だけでは酸化還元に同期した電子の移動の制御機構を考 えることは難しい。Phe377が酸化還元等にに伴う構造変化によってこの制御に関与す る可能性はある。
CuA活性中心には6個の配位子がある電子密度図や異常散乱の差のフーリエ合成の ピーク値からこの活性中心を[2Cu-2Sγ]としてモデルを作成した。このモデルではそ れぞれのCu原子にCys196, Cys200, His161, Met207及びCys196, Cys200, Glu198のカル ボニル・His204が合理的な4面体配位をとっている。cu-cuは2.7Åでsγ-sγは3.8Åで ある。この構造は植物型フェレドキシンの[2Fe-2S1活性中心と良く似た構造である。 フェレドキシンの活性中心では電子が2個の鉄原子間で非局在化していることが知ら れている・[2Cu-2Sγ]活性中心においても還元状態では[Cu+1.5…Cu+1.5]のような電子 が非局在化した電子配置をとるであろう。
この活性中心は膜間側で最も近い表面の原子から約5Åと表面に近いところにある。 このことはこの活性中心が最初にチトクロムcから電子を受け取る部位であることと も良く符合している。CuA部位からヘムaあるいはヘムa3への電子伝達経路があるは ずである。CuAに配位したサブユニットIIのHis204はArg438とArg439の間のペプチド のカルボニルと水素結合している。そのペプチドのイミノ基はヘムaのプロピオン酸 と水素結合しており電子伝達の起こりやすい経路ができている。一方、ヘムa3へは銅 に配位したサブユニットIIのGlu198の側鎖が、後で述べるマグネシウムに配位してお り、同じマグネシウムの配位子であるHis368がヘムa3のプロピオン酸と水素結合をし ている。この系と比べてヘムaへの系はより直接的であり、ヘムaへの電子伝達が優先 的に起こることと良く一致している。
5. 考察
2量体で40万の分子量であったが、通常の重原子同型置換法によって構造決定する ことができた。この成功の原因は、高分解能の回折像を与える結晶得られたこと、精 度の良い回折強度測定が行えたことに尽きる。測定精度の向上はまだまだ可能である。 特に弱い反射の測定精度を向上させることによって重原子同型置換法による構造解析 の可能性は益々拡げることができる。
この研究は姫路工業大学理学部の吉川信也教授、新沢一伊藤恭子博士らとの長年の 共同研究によって行われた。この研究の実施に際してはTARAプロジェクト(ウイル スなど超巨大分子の研究)、文部省科学研究費重点領域研究及び試験研究Bの援助を 得た。また放射光の利用に当たっては、高エネルギー物理学研究所放射光実験施設の 助言者委員会の許可を得て行なった。
文献