
1. はじめに
有性生殖系の生物は,すべて精子と卵という配偶子を形成し,受精という生命現象 を通して生命を連続させている。生体内において,哺乳動物精子が卵との問で受精を 成立させるには,卵の細胞外マトリックスである透明帯を通過することが必要不可欠 である。この卵透明帯が単なる精子侵入の障害物としてではなく,厳密な認識機構に 基づいた精子の付着や結合の役割を果していることが明らかになってきている1)。い ずれにしろ,精子の卵透明帯通過は,精子中に含まれる酵素の消化作用と精子自身の 機械的な運動性により成し遂げられていると考えるのが自然である。事実,精子はそ の頭部先端に先体胞(アクロソーム)とよばれる加水分解酵素を含む細胞内小器官を もっており,卵透明帯からの「刺激」によって引き起こされる精子アクロソーム反応 により,これらの加水分解酵素を放出して精子の透明帯通過を容易にしているものと 考えられている。このようにアクロソームは,受精のために必要不可欠な精子の小器 官である。
アクロシンは,哺乳動物精子アクロソームに局在するセリンプロテアーゼである2)。 ほかのセリンプロテアーゼと同様,アクロソーム中では酵素的に不活性な前駆体プロ アクロシンとして存在しており,アクロソーム反応に伴い自己触媒的に活性型のアク ロシンに変換される。活性化されたアクロシンは,卵透明帯を構成する糖タンパク質 を溶解することによって精子の卵透明帯通過を助けていると長い間考えられてきた。 また,フロアクロジンとアクロシンが,卵透明帯やフコースをはじめとするいくつか の糖に結合するレクチン様の活性を持っていることも見いだされた3,4)。したがって, このタンパク質が精子の卵透明帯通過だけでなく,精子と卵透明帯との種特異的結合, 精子アクロソーム反応の誘起などにも関与している可能性がある。しかし,アクロシ ンの受精での真の機能・役割についての直接的な証明は,いまだに報告されていない。

他方,アメリカでは男性不妊診断のひとつのマーカータンパク質としてこのアクロシ ンが利用されつつあり,医薬品としての価値が探られている。
一方,精巣で作られる精細胞は,分化してハプロイドの精子となる。その精子の形 成過程は,精細管内部で進行し,精原細胞を生じる過程,2回の減数分裂により半数 体細胞(球状精細胞)を生じる精母細胞過程,球状精細胞が成熟精子へと変態を遂げ る過程から成っている。この分化過程において,精巣に特異的なタンパク質を含むさ まざまな遺伝子が,それぞれ選択的に活性化,あるいは不活性化されることが知られ ており5),このような遺伝子の発現制御が精子形成と分化に不可欠であると考えるこ とができる。また,このような遺伝子の精子形成過程中での発現は,あらかじめプロ グラミングされていると考えることもでき,そのスウイツチをオンの状態にする因子 を探ることも興味深い。いずれにせよ,アクロシンがアクロソームという精子特異的 小器官に存在するために,その遺伝子の構造や発現機構を調べることは重要であり, 精子形成という未知の課題に多くの知見が得られるものと期待できる。ここでは,著 者らの研究室で得られた哺乳動物アクロシンに関する最近の研究の概要を紹介する。
2. 哺乳動物精子アクロシンの構造
哺乳動物由来のアクロシンは,遺伝子クローニングによって,まずブタ6,7)から, 続いてヒト8),マウス9,10),ラット11)からそれらの全一次構造が決定された(図1)。報告されてはいないが,モルモット(Gertonら,未発表)とウサギの配列(Houand ら,未発表)もすでに明らかとなっている。いずれも一本鎖のプレプロアクロシンと して合成され,アミノ末端から新生タンパク質膜通過の際に機能するシグナルペプチ ド,成熟タンパク質の軽鎖に相当する配列,重鎖に相当する配列の順に構成されてい る。ブタ,ヒト,マウス,ラットの4種間のアミノ酸配列の相同性は,およそ60% 以上であり,軽鎖の構成アミノ酸の数,セリンプロテアーゼとしての活性アミノ酸残 基の位置,N結合型糖鎖の付加可能なアスパラギンの位置,12個のシステインの位 置などは,4種間ですべて保存されている。ただし,マウスには13個のシステイン が含まれており,この余分の1個のシステインは,分子中ではサルフヒドリル基にな っているはずであり,これがプロテアーゼ活性なとととのように関係しているかは不 明である。さらに,軽鎖およびプロテアーゼ活性残基近傍の領域では,ブタ,ヒト, マウス,ラット4種間で非常に高い配列の相同性が認められるが,重鎖のカルボキシ ル末端近傍の相同性は,ブタアクロジン中間体のプロセシング部位付近(後述)以外 はそれほど高くない。特に,ブタ,ヒトで見られるプロリンの連続配列が,マウスや ラットにはほとんど存在しない。さらに詳しい検討が必要であるが,このカルボキシ ル末端近傍の配列は,けっ歯と非けっ歯動物により区別されるように思われる。これ らの結果から,一本鎖フロアクロジンは,軽鎖に相当する23アミノ酸残基の配列と 重鎖に相当する配列の間で二つのジスルフィド結合によって連結されており,それら の配列間のペプチド結合の切断によって,二本鎖成熟アクロシンヘと変化することが 明らかとなった。したがって,アクロシンは,シグナルペプチドを含むプレプロアク ロシンとして生合成され,シグナルペプチドの除去後酵素的に不活性なフロアクロジ ンとしてアクロソー一ムに運搬,保存され,アクロソーム反応前後にアクロシンに変換 されると考えることができる。
3. フロアクロジンのプロセシングと活性化
フロアクロジンの一般な生化学的性質は,精製方法の確立されているブタ射出精子 からのものについて詳しく検討されている12,13,14)。ブタプロアクロシンを用いて,その生体外でのプロセシングと活性化の機構を調べた6)。精製したフロアクロジンを 弱アルカリ性のpHで反応させると,分子量55キロダルトンのフロアクロジンは, 反応初期に53キロダルトンのフロアクロジンに変換され,さらに49,43キロダ ルトンの中間体を経て,最終的に35キロダルトンの成熟アクロシンに変化した15) (図2A)。ブタプロアクロシンのプロセシングを明確にするために,5種類の異な る分子量のフロアクロジン,アクロシン中間体,成熟アクロシンを単離し,各々につ いてアミノ末端とカルボキシル末端からのアミノ酸配列について解析した6,15,16)。 分子量55と53キロダルトンのフロアクロジンは,どちらもアルギニンで始まる単 一のアミノ末端配列であった。このことは,フロアクロジンが一本鎖のポリペプチド であることを示しており,さらに興味深いことに,1番目から23番目までの配列は アクロシン軽鎖のものと完全に一致し,重鎖の配列がそれに続いていた。一般的に, セリンプロテアーゼ前駆体は,活性型の酵素に変換する際に切断される活性化ペプチ ド断片をアミノ末端に持っている。したがって,アミノ酸23個よりなるアクロシン 軽鎖は,その活性化ペプチドに相当していると考えることができる。実際に,49, 43,および35キロダルトンのアクロシンからは,軽鎖と重鎖に対応する2通りの アミノ酸配列が見いだされた。カルボキシル末端アミノ酸配列を解析すると,分子量 53キロダルトンのフロアクロジンと49キロダルトンのアクロシン中間体は,まっ たく同じカルボキシル末端配列を有していた(383番目のアルギニンがカルボキシ ル末端アミノ酸)。また,55,43,および35キロダルトンのフロアクロジン, アクロシン中間体,成熟アクロシンのカルボキシル末端アミノ酸は,それぞれ397 番目のプロリン,365番目のリシン,322番目のアルギニンと決定した。アミノ 末端アミノ酸配列を考慮すれば,この53と49キロダルトンのタンパク質の構造上 の相違点は,アミノ末端より23番目のアルギニンと24番目のバリンの間のペプチ ド結合が切断されているか否かだけである。分子量55と53キロダルトンのフロア クロジンは酵素的に不活性であったが,49,43,および35キロダルトンのアク ロシン中間体と成熟アクロシンはすべて活性型であったので,そのペプチド結合結合 の切断がフロアクロジンの活性化,すなわちアクロシンタンパク分子内の立体構造の 変化にともなう活性部位の形成などに関与していることが判明した。
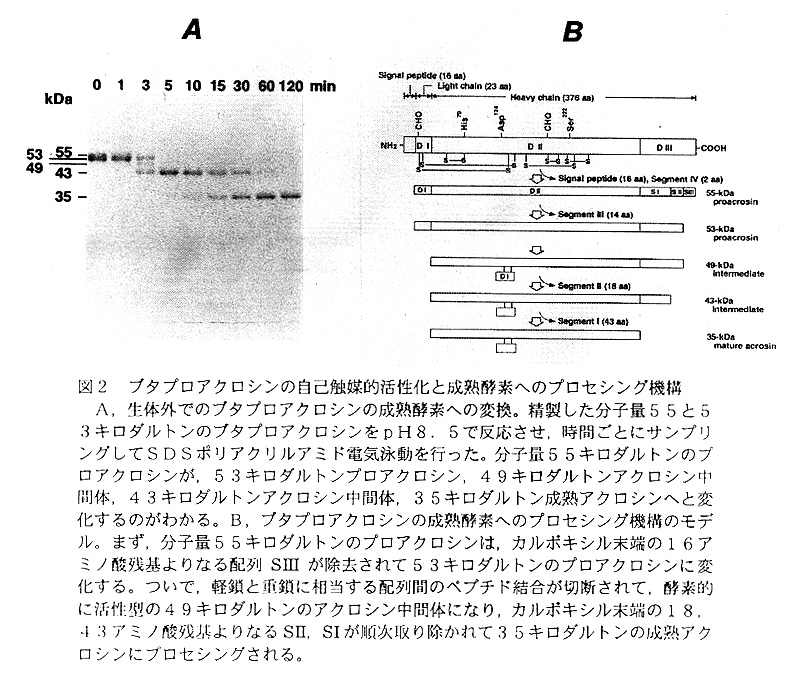
また,プロアク ロジンのアミノ末端付近でのプロセシングが軽鎖と重鎖間のペプチド結合の切断だ けということは,フロアクロジンから成熟アクロシンヘの変換の間に起こる分子量の 変化は,カルボキシル末端からのペプチドの除去であるということを反映している。 以上の結果より,分子量55キロダルトンのフロアクロジンは,アミノ末端近傍のぺ プチド結合の切断とカルボキシル末端からのいくつかのペプチド断片の除去という 二つのプロセシングにより成熟アクロシンに変換されることが明らかとなった6)(図 2B)。
ところで,分子量49キロダルトンのアクロシン中間体が43キロダルトンのもの にプロセシングされるときの切断点近傍のアミノ酸配列は,動物種にかかわらず高い 相同性を有している(図1)。最近になり,われわれは,フロアクロジンに特異的に 結合するタンパク質(sp32)をブタ精子より精製することに成功した17)。この フロアクロジン結合タンパク質は,その相同性の高い切断部付近の配列を認識し結合 している可能性が見いだされた。また,ブタやマウス,ヒトより卵透明帯結合タンパ ク質sP38を同定してcDNAクローニングを行ったが,sP38中の11残基の 配列がこのアクロシン中間体の切断点近傍のアミノ酸配列と高い相同性を示すこと が判明した18,19)。実際に,これらの配列に対応するペプチドを作製して卵透明帯 との結合能を調べたところ,両方ともにその活性を有していることが明らかとなった19) 。このことが,生体内でどのような意味を持っているのか,またフロアクロジン のプロセシングにともない遊離されるカルボキシル末端にあるペプチド断片の生理 的意義など,今後明らかにしなければならない課題は多い。
4. 精子形成過程でのアクロシン遺伝子の発現
精子形成は精細管内部で進行し,2回の減数分裂によりハプロイドの球状精細胞を 生じて精子へと変態を遂げる。アクロソームが,前期球状精細胞の生成直後に形成さ れ始めることから,アクロシンを含むアクロソームタンパク質は減数分裂後に生合成 されていると考えることができる。事実,間接蛍光抗体法により前期球状精細胞の初 期にアクロシンの合成が開始され,成熟精子でも高いレベルでそのタンパク質が保持 されていることが報告されている20,21)。一方,精子細胞特異的に発現されるタン パク質に対する遺伝子が同定・単離され,それらの遺伝子の精子形成過程中での転 写・翻訳時期がこれまでにマウスを中心として詳しく調べられてきた。しかし,残念 なことにアクロソームに局在するタンパク質の遺伝子発現に関する情報はひとつも 報告されていなかった。これは,とりもなおさずそれらの遺伝子が単離されていなか ったためである。われわれは,アクロシンをはじめとするいくつかのアクロソームタ ンパク質遺伝子を指標として,精子形成過程でのアクロソームの形成とアクロソーム タンパク質遺伝子の発現について調べた9,22)。
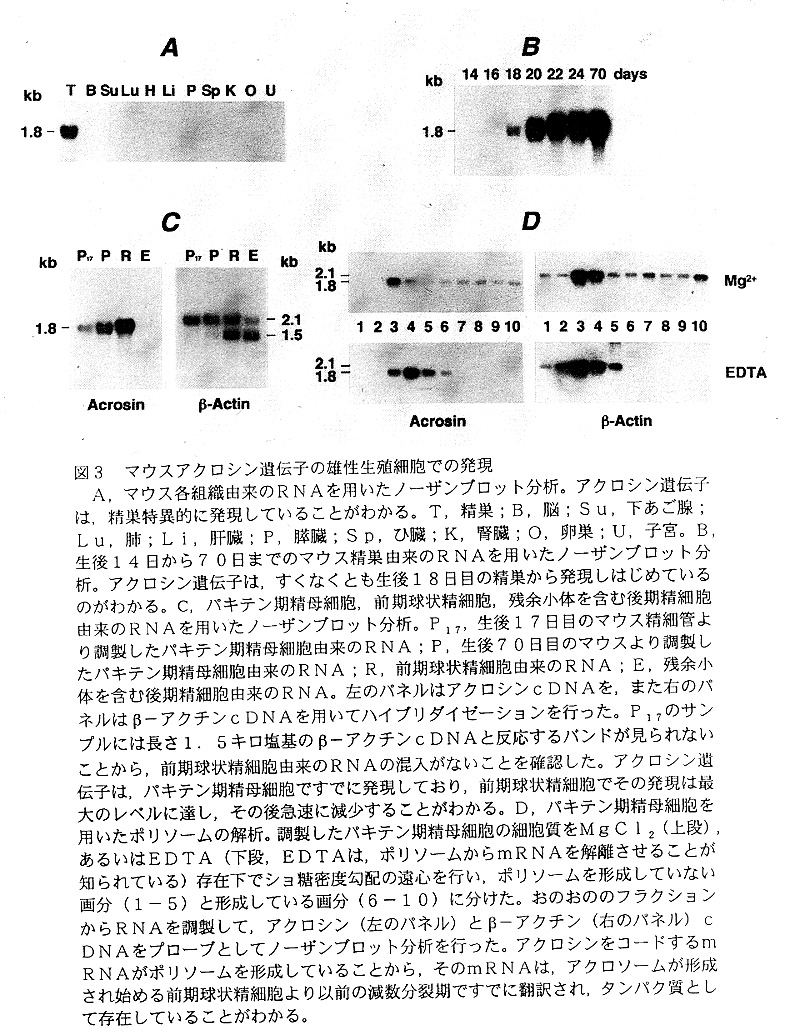
まず,アクロシン遺伝子の発現の有無を明らかにするために,マウスの精巣を含む 各組織と生後14日から70日までの精巣よりRNAを調製し,アクロシンcDNA をプローブとしてノーザンプロット分析を行った(図3)。アクロシン遺伝子は精巣 特異的に発現しており(図3A),そのmRNAは,生後18日の精巣ではっきりと 検出され,それ以後その量は著しく増加していた9)(図3B)。マウスでは生後18 日目の精巣精細管中の精子細胞は,前期球状精細胞がほとんど含まれておらず,その 後になってその細胞が増加していく23)。したがって,この結果はみかけ上,アクロ シンが減数分裂後の半数体精細胞で生合成されていることを示唆している。このこと を確かめるために,精細管よりパキテン期精母細胞,前期球状精細胞,残余小体を含 む後期精細胞を分画・精製してノーザンブロット分析を行った22)(図3C)。アク ロジン遺伝子は,パキテン期精母細胞ですでに発現しており,前期球状精細胞でその 発現は最大のレベルに達し,その後急速に減少することが明らかとなった。また,パ キテン期精母細胞と前期球状精細胞を用いたポリソームの解析を行い,アクロシンm RNAは,アクロソームが形成されはじめる前期球状精細胞より以前の減数分裂期に すでに翻訳されていることを明確にした22)(図3D)。さらに,アクロソームタン パク質であるsP38とsP32についても,まったく同じ結果が得られた(未発 表)。したがって,アクロシンを含むアクロソームタンパク質は,減数分裂期にそれ らの遺伝子発現が開始されていること,また合成されたタンパク質がゴルジ装置に輸 送され,そのオルガネラ由来のフロアクロソーム穎粒を生じて半数体精細胞期にこれ らが集合することによりアクロソームが形成されていると考えることができる。
5. マウスアクロシンの受精での機能解析
前述のとおり,哺乳動物精子アクロソームに局在するアクロシンは,そのセリンプ ロテアーゼ活性により卵透明帯を限定分解するために,精子の透明帯通過に不可欠な ものであると長い間考えられてきた。しかし,アクロシンの受精での真の機能・役割 についての直接的な証明は現在まで得られていない。このような観点から,アクロシ ンの生体内での役割を明確にすることを目的として,標的遺伝子相同組換え法を用い てアクロシン欠損マウスを作製することを試みた24)。
マウスアクロシン染色体遺伝子は,4個のイントロンにより分断される5個のエク ソンより構成されており25),15番目のマウス染色体上にシングルコピーとして存 在している26,27)。また,セリンプロテアーゼとしての活性残基であるヒスチジン, アスパラギン酸,およびセリンは,それぞれ第2,第3,第5エクソンに位置してい る。ほかのセリンプロテアーゼ遺伝子と比較すると,アクロシン遺伝子はトリプシン やカリクレイン遺伝子と起源を同じくし,その進化過程で軽鎖やカルボキシル末端部 分に対応する領域が付加され,さらに,雄性生殖細胞特異的発現の特徴を獲得したも のと考えられる。
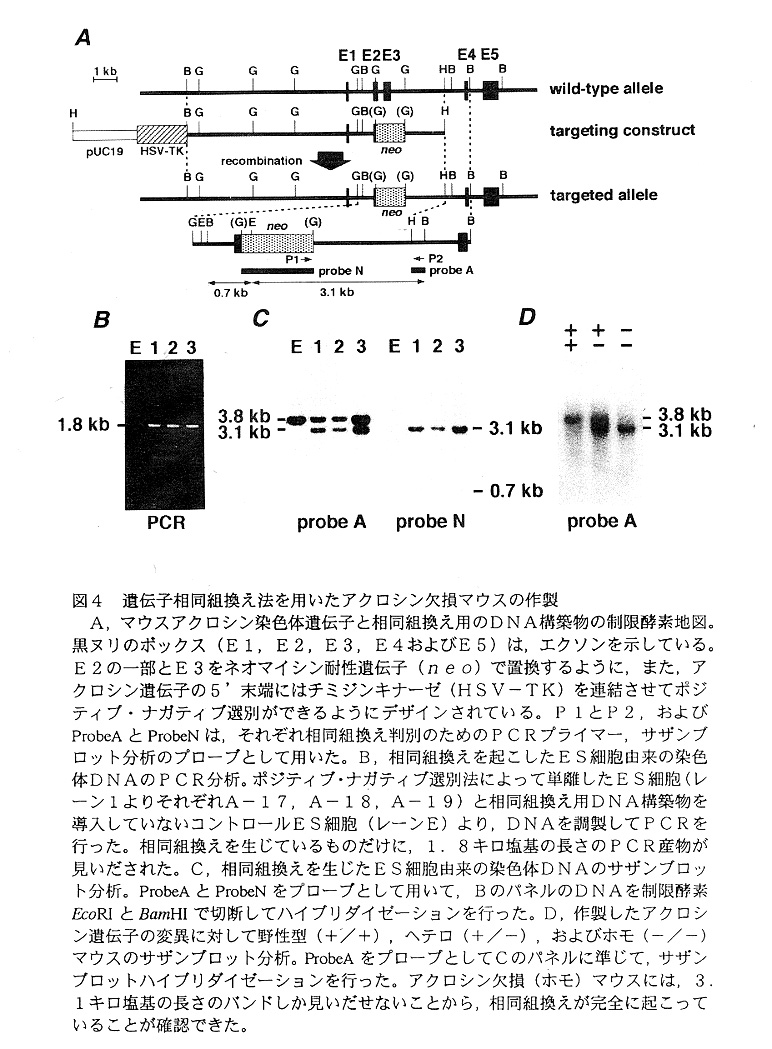
標的遺伝子相同組換え法によりアクロシン欠損マウスを作製するために,マウスア クロシン染色体遺伝子の第2エクソンの一部と第3エクソンを含む領域をネオマイ シン耐性遺伝子で置換したようなベクターDNAを構築した24)(図4A)。もし正 常に相同組換えが生じれば,これらのエクソン中にはプロテアーゼ活性のための3個 の活性残基のうち2個が,また,分子内のジスルフィド結合に関与しているシステイ ンが5個含まれているので,結果として正常なアクロシン遺伝子転写物が生成されな いか,たとえ生成されたとしても不活性なアクロシンしか生産されないはずである。 構築したDNAをA3-1胚性幹細胞28)に電気的に導入して,G418による選別 後,相同組換えの起こった細胞株をPCRとサザンプロット分析により同定し(図4 BとC),胚盤胞に注入して仮親に移植した。生まれたキメラマウスからのヘテロ接 合体同士の交配により変異遺伝子に関してホモのマウスを得た(図4D)。
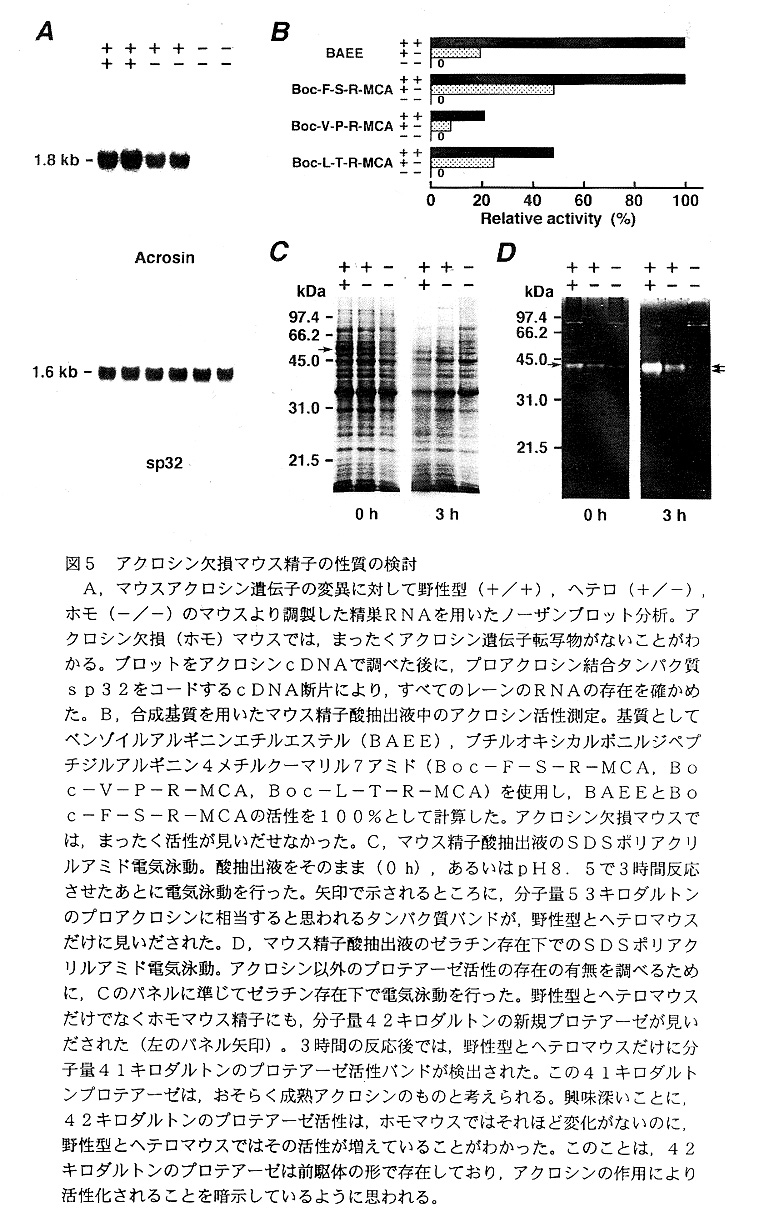
まず,野 性型,ヘテロ,ホモマウスの精巣よりRNAを調製してノーザンブロット分析を行い, アクロシン遺伝子の発現の有無を調べた(図5A)。予想したとおり,ホモマウスで は正常なアクロシン遺伝子転写産物がまったく存在せず,ヘテロマウスでは野性型マ ウスの約半分量しか見いたされなかった。また,精巣上体精子の酸抽出液を調製して 合成基質を用いてアクロシンプロテアーゼ活性を測定したところ,ノーザンブロット 分析の結果と同様,ホモマウスではまったくプロテアーゼ活性が検出できなかった (図5B)。以上の結果から,作製したホモマウスがアクロシンを完全に欠損してい ることを確認したホモマウスでの精巣精細管中の各種精子細胞の形態と精巣上体精 子のアクロソームの形態にもまったく異常がなく,精子の運動性も野性型のものと同 じであった。もし,アクロシンが精子の卵透明帯通過に必要であるとすれば,作製し たアクロシン欠損マウスは交配能力を欠いているはずである。しかし,F2とF3の アクロシン欠損オスマウスはすべて交配能力を有しており,自然交配により正常な子 孫を得ることができた。さらに,体外受精試験を行い,アクロシン欠損マウス精子の 卵透明帯通過能と卵との受精能を確認することができた(データ省略)。これらの結 果から,アクロシンは受精に必須の分子でないと結論した。しかし,興味深いことに, 野性型と比べてアクロシン欠損マウス精子は,媒精後短時間では卵透明帯通過と受精 に時間的遅れを生じていることが判明した(データ省略)。
哺乳動物精子のセリンプロテアーゼ活性が精子の卵透明帯通過に不可欠であると いう仮説が真実ならば,アクロシン以外のプロテアーゼが精子に含まれているはずで ある。アクロシン欠損マウス精子の酸抽出液を用いて,ゼラチン存在下でSDSポリ アクリルアミド電気泳動を行い,そのことについて検討した(図5CとD)。驚いた ことに,アクロシンを完全に欠損するアクロシン欠損マウスにも,分子量42キロダ ルトンのゼラチン分解活性を持つプロテアーゼが見いだされた24)(図5D)。また, 各種プロテアーゼ阻害剤を用いた実験から,そのゼラチン分解活性を持つ新規タンパ ク質がセリンプロテアーゼのファミリーに属することも明らかとなった。現在,その 新規プロテアーゼの精製と性質の検討,および遺伝子の単離を行っている。
6. おわりに
アクロシンが精子細胞のアクロソーム特異的に主要タンパク質として存在してい るために,精細胞の分化・形成,アクロソームの形成,受精での精子の機能解析など の研究におけるひとつのモデルとして詳しく調べられてきた。アクロシンの受精での 機能と役割が卵透明帯の部分的な加水分解であり,その作用によって精子の透明帯通 過が助長されていると疑う余地がなかった。しかし,それが精子の透明帯通過に必要 不可欠のものでないことが証明された今,あらためてその生体内での役割を考え直す 時期がきたといえる。はたして,アクロシンが存在する生理的意義は何なのか?また, その生体内での真の基質は何なのか?アクロシン欠損マウスを用いた予備的な検討 から,その精子が卵丘細胞間のマトリックスを通過する速度が遅いことや卵透明帯に 付着・結合したあとのアクロソーム反応に遅れを生じていることなどが見いだされつ つある。また,精子酸抽出液に見いだされた,分子量42キロダルトンの新規プロテ アーゼの活性化をアクロシンが助長している可能性も明らかにされつつある。したが って、アクロシンが直接,精子と卵の相互作用に参加しているというよりも,ある種 のモジュレーターとして機能しており,そのタンパク質分解活性によってほかの精子 タンパク質に機能を与えているのかもしれない。今後の詳細な検討により,そのアク ロシンの機能・役割が次第に明らかにされていくものと期待している。さらに,アク ロシンと新規プロテアーゼ,卵透明帯の立体構造を明らかにすることができれば,そ れらのプロテアーゼ間,あるいはプロテアーゼと卵の細胞外マトリックス間,ひいて は精子と卵の細胞間相互作用などについてより明確な情報が得られることと同時に, これらのプロテアーゼの阻害剤などの研究を通して新しい避妊薬の開発なども可能 になるものと思われる。
参考文献