「構造生物」の編集委員会より表記の題で連載を頂戴しました。今回より三回に分けて、低温下での蛋白質X線結晶構造解析について以下の内容を纏めたいと考えております。
内容は筆者がかなり気紛れであることもあって、多少変更するかもしれません。この連 載にて取り上げます低温結晶解析の技術は、蛋白質結晶の放射線損傷を低減させる目的で利用されることが多くなっております。第一回目は、理化学研究所での低温実験実施の 経緯と、海外での低温蛋白質結晶学を概観して見ることにしました。なお、連載内容は、筆者が平成7年10月16日に理化学研究所で行いました物理化学研究会"低温下での蛋 白質X線結晶構造解析における実験技術"および筆者が作成中の低温実験のマニュアルを 要約した形式とさせていただきます。
筆者は、大学院生のころから放射光実験施設において、蛋白質の液体窒素温度下やドライアイスーアセトン系温度下でのX線回折散乱実験を行っていました。おもな目的は、 バクチリオロドプシンという膜蛋白質の光反応中間体の構造解析でありました。当時の 実験手法は、色々な制限もあり、今から考えると幼稚で、また、その操作性の悪さには閉口したものです。そのときの経験では、冷却領域を小さくとること、温度可変であるこ と、定常冷却の持続性、操作性と迅速冷却などが課題として残されました。
理化学研究所の生物物理研究室に着任してまもなく平成6年の4月放射光構造生物学研 究推進グループが発足しました。そのグループの大きな課題として大型放射光施設での 構造生物学研究のためのビームライン建設があります。この課題の中で、大型放射光で の蛋白質結晶の放射線損傷対策として、低温実験技術の導入が提案されました。当初は、低温実験などというまどろっこしい実験技術は大型放射光施設でも不必要であるという意見もありましたが、とりあえず、装置の選択や結晶マウント貝の素材検討や開発が始まりました。幸運なことに、東京大学分子細胞生物学研究施設の豊島近教授が理化学研究所 ブロディア研究員を兼任されており、生体高分子試料の電子顕微鏡観察における冷却技術をいろいろとご教示頂きました。特に、豊島先生がアンウィンと作成された冷却装置を お借りして、冷却媒体の特性や結晶マウント臭の冷却についていろいろと試行錯誤を行わせていただきました。実際の低温実験は吹き付け型低温冷却装置が到着した10月ごろ から始められました。実験時間は非常に限られておりましたが、11〜12月にはリゾ チーム、ヘモグロビンやトリプシンの結晶にて予備実験を行い、平成7年の2月ごろより 筆者以外のユーザーによる実験が開始されました。現在までに11種類の蛋白質結晶の 回折強度測定を低温下で行われ、その内3種類については、高エネルギー物理学研究所放 射光実験施設のBL18Bにおいても回折強度測定がなされました。
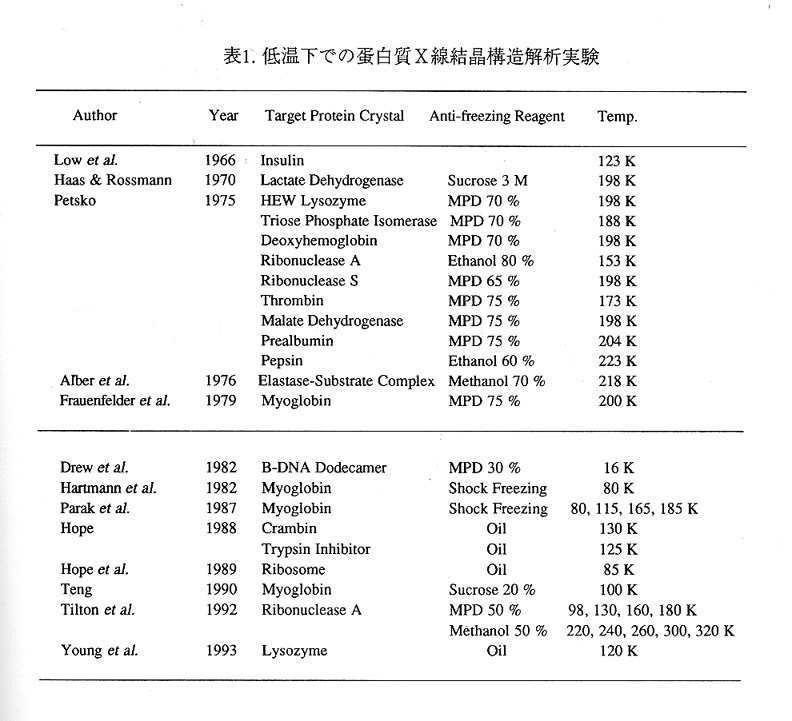
今回は、第一回ということで過去にどのような低温実験が行われてきたかを概観してみ たいと思います。筆者はあまり文献を良く読むほうではないのですが、そのような過小 な知識をもってしても低温蛋白質結晶学の歴史をひもとくことができるほど主要な文献は 限られています(表1)。
最初に低温下でのX線回折実験を行ったのは、ロウらのグループであります(Low et al,1966)。彼女らは、インシュリンの放射線損傷を低減する目的でインシュリン結晶 を液体窒素につけて回折パターンを得ておりますが、十分解析に足るものではなかったよ うです。
1970年代になりますとウイルスの構造解析で有名なロスマンの研究室から最初の 定量的な低温実験データが発表されました(Haas & Rossmam,1970)。彼等がターゲッ トとしましたのは、乳酸脱水素酵素の結晶で、-75℃程度の低温下での実験を通じて、 乳酸脱水素酵素結晶の放射線損傷が著しく低減されることが示されております。低温実 験での難点は、蛋白質結晶を冷却することで蛋白質結晶内体積の30%以上を占める水が 六方晶の氷として結晶化してしまうことです。

氷の成長は脆弱な蛋白質結晶をこともな く破壊します。実際に試されるとよいのですが、蛋白質結晶を徐々に冷却してやると結 晶母液が凍って蛋白質結晶が白濁します。ハースとロスマンはこの現象を回避するため に高濃度のショ糖を結晶母液に浸透させました。一般に、ショ糖やグリセロール等の抗 凍結剤と呼ばれる薬剤は、水溶液中で氷の生成を阻害し、同時に水をガラス状態に凍結さ せる性質を持っています。そのような薬剤を蛋白質結晶を破壊することなく結晶母液中 に導入することができれば蛋白質結晶の破壊を回避できるわけです。
蛋白質結晶冷却のための抗凍結剤の導入という手法は、ペツコによって更に適用範囲が 拡大されるとともに、導入手順が確立されました(Petsko,1975)。その詳細は、ペツコ によって書かれた1975年の論文に見ることができます。更に、彼等は、エラスター ゼのアシル中間体の構造解析を行うに当たってこの技術を応用しています(Alber,Petsko & Tsemoglou,1976)。同時に、その研究を支援する目的で、低温下での酵素反応キネテイ クスも詳細に調べられました(Fink & Ahmed,1976)。この技術はその後もペツコの研究 室にて維持され、1992年には、リボヌクレアーゼAのガラス転移測定に利用されてい ます(Rasmussen et al.,1992)。
1970年代の低温実験技術は、おもにサブゼロと呼ばれる温度範囲(-100℃以上) で行うことを目的として開発されたようです。
1980年代には、低温結晶解析実験にとって大きな技術導入がありました。それは、 結晶冷却における液体ガスの利用です(Hartmann et al.,1982;Parak et al.,1987)。フラウ ェンフェルダーらは一酸化炭素が結合したミオグロビンの低温分光測定を通じて"プロテ インクェイク"という概念を提唱しており、その構造的実態を見るために低温下での一酸 化炭素ミオグロビン結晶の構造解析に着手しました。ハルトマンらは1970年代の技 術とは異なり、硫酸アンモニウムで結晶化された一酸化炭素ミオグロビン結晶を、直接液 体プロパンに投入することで、瞬時に結晶母液をガラス状態に凍結させ、複数の温度点で の高分解能構造解析を行うとともに温度因子の温度依存性を調べました。液体ガスは既 に生体試料の電子顕微鏡観察において使用されており、今日では、膜蛋白質の電子顕微鏡 構造解析に不可欠な技術となっております(Robards & Sleytr,1985)。液体ガス(特に液 体エタンや液体プロパン)の利点は、その沸点が高いことです。寒剤として広く利用さ れている液体窒素の場合には、沸点が低いことにより、温熱物体の挿入時には発泡が生じ (ライデンフロスト現象)、熱伝達が著しく妨げられますが、液体ガスでは発泡現象が生 じず、十分な冷却速度を実現することが可能です。硫酸アンモニウムを多量に含んだ水 溶液は急速冷却によってガラス状態に凍結することが可能です。これらの利点を生かし たのがフラウェンフェルダーらの物性物理屋さんだったわけです。
1980年代の終りごろには、低温実験専用の結晶マウント具が開発されました。ホ ープらは、リボゾーム結晶の低温回折強度測定において、スパチュラと呼ばれる結晶マウ ント具を使用しました(Hope,1988;Hope et al.,1989)。これは薄い石英板を1枚ないし2 枚をガラスファイバーの先端に接着したものです。リボゾーム結晶は力学的に脆弱なた め、この結晶マウント具によって結晶をすくいとり素早く液体プロパンにて急速冷却を行 うというのが彼等の考案した手法です。1989年のホープらの論文には、一連の作業 が写真入で解説されており一見の価値があります。また、彼等は抗凍結剤を使用せず、 鉱物油にて蛋白質結晶を凍結ショックから保護するという方法を用いました。
1990年には、今では有名になった感のあるテンの金魚すくい方式の結晶マウント具 が発表されました(Teng,1990)。この結晶マウント具は細い金属線や高分子糸(径は1 00ミクロン程度)をつかって直径2ミリメートル程度の輪を作成し、結晶母液の表面張 カを利用して、その中に結晶をすくいとります。現在では、このタイプの結晶マウント 具がチャールズサッパー社やハンプトンリサーチ社から市販されるようになっています。
また、数多くの低温実験において、このテンの発明した結晶マウント具が使用されてい ます。
アメリカでは、これらの背景にもかかわらず、低温実験の普及はアメリカでは1994 年からだそうです。ハーバード大学のロジャーズという人が片っ端から蛋白質結晶の冷 却を行い、これは使い物になるといって周囲に勧めてからアメリカでの利用が大きく進展 したようです(Rodgers,1994)。現在は、抗凍結剤の導入と急速冷却を組み合わせた手順 が、低温結晶解析での一般的な手法になりつつあるようです。
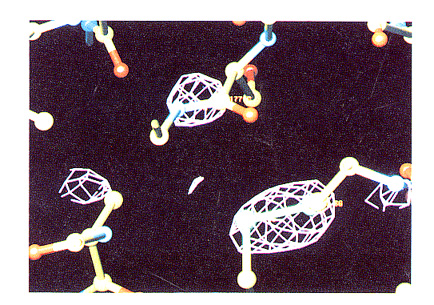
放射線損傷によって蛋白質あるいは蛋白質結晶内で何が起こっているのかはあまり取り 上げられることがありませんが、ここでは、放射線損傷の実態ではないかという実験結果 を取り上げてみたいと思います。硫酸アンモニウムで結晶化されたトリプシン結晶に室 温下で196時間実験室のX線発生装置より得られる銅のkα線を照射しました。照射 している間に振動結晶法によって14のデータセットを収集しました。図1に示しまし たのは、最初のデータセットを用いて構造精密化されたモデルより計算される位相、最初 と最後のデータセットの回折振幅を用いて、以下の差フーリエ合成を行った結果です。
[F1st-F14th]exp(iα1st)] プラスのピークのみを描いてありますが、その殆とがトリプシンに存在するジスルフィ ド結合とその近辺のペプチド結合に存在しておりました。この結果は、実験室での長時 間のX線露光によっても蛋白質内のジスルフィド結合が切断される可能性を強く示唆して います。同様なジスルフィド結合の切断は、放射光X線を用いたインシュリン結晶での データ収集でも報告されております(Helliwell, 1988)。このような現象や、今回の実験 の時間スケールでは測定困難なラジカルの発生が蛋白質結晶の放射線損傷をもたらすので はないかと考えられます。
次回からは、放射線損傷低減を目的とした実験手法について簡単にまとめてみたいと 考えております。 参考文献 (アルファベット順)