最近のX線やNMRによる蛋白質の立体構造解析は、その機能を説明する手段 として必須な手法となっている。従来から行われている遺伝的手法や生化学的手 法とかみ合わせることにより、原子レベルでの蛋白質の機能を視覚的に提供し生 物学の発展に大きく寄与している。
蛋白質の構造解析を行うにあたり一番最初に直面する最も大きい問題が、目的 蛋白質をいかに大量に純度良く機能を持った形、言い替えると正しい構造を持っ た形で手に入れられるかであると思われる。もともと生体内に大量に存在する蛋 白質は別として、大量の蛋白質を産生させる系としては、大腸菌の系が最も簡単 で現実的であると考えられる。特に、NMRによる構造解析においては、蛋白質 をラベルする必要が生じるため大腸菌による発現系が必須となる。しかし、動物 細胞由来の蛋白質を大腸菌内で産生させると種々の問題が生じることがある。そ の問題の一つは、産生させた蛋白質が不溶性となり封入体を形成し機能を持たな いポリペプチドになってしまうこと・もうひとつは、強力なプロモーターを用い でもほとんど蛋白質の産生が見られないことがあることである。さらに可溶性画 し分に大量に得られても、蛋白質の取扱いについては、DNAの取扱い技術に比 べ、個々の蛋白質の物理化学雌質が大きく異なるので精製方法等、各論として しか議論できない。このように蛋白質を扱う種々の問題が数多く存在している。 それ故、蛋白質を扱う人が少なくなっているようにも見える。
これらの問題点を解決するには、現在ある技術では完全に克服することは、で
きない。しかしながら、ある程度の対症療法的手段は存在するのでこれらを組み
合わせて戦略を立てることができると思う。本稿では、まず構造解析のための大
腸菌における蛋白質産生系作成の実際的ポイントをまとめてみた。
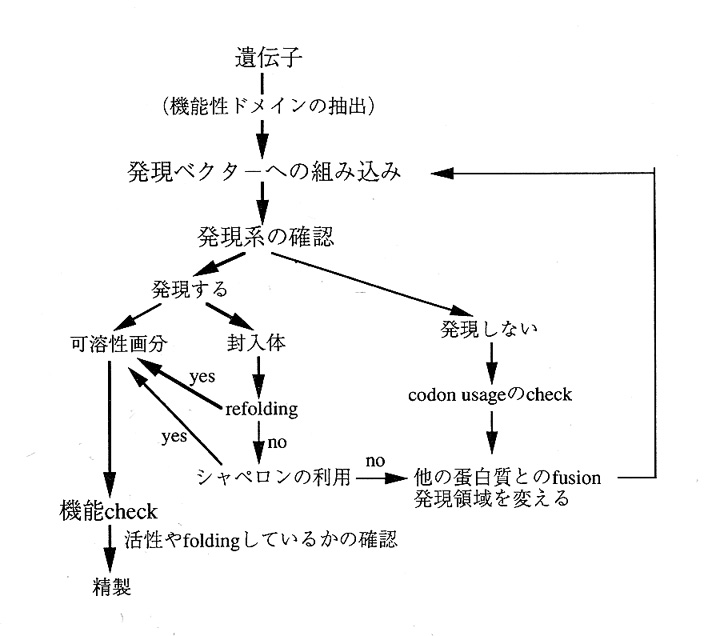
現在、我々が行っている蛋白質作成のフローチャートを下記に示した。この流
れに沿って説明する。
(1)発現ベクターの選択と目的遺伝子の組み込み
目的とする蛋白質が1つのまとまったドメインとして存在するならば、何も考
えずにその遺伝子全体を発現ベクターに挿入すれば良いが、かならずしもそうと
は限らない。例えば、膜蛋白質の膜結合部位を切り取って細胞外ドメインだけ発
現させたり、複数の機能ドメインが存在するような時には、そのうちのあるドメ

インだけを発現させるさせることは、決して珍しいことではない。生物学的意味 を考えると邪道かもしれないが、結晶化や解析の難易度を考えるとこのほうが有 利であると思われる。このようにどの領域を発現させるかは、ホモロジーによる 検索や生化学的知見を参考にして決定するのが妥当だと思う。PCRの手法が発 達している現在では、どの領域でもDNAオリゴマーさえ合成すれば、簡単に発 現させることができる。
大腸菌に他の生物由来の蛋白質を産生させることは、大腸菌にとっては有害と なりその増殖が阻害されることが少なくない。このため、大腸菌がある程度まで 増殖するまで目的蛋白質の産生を止めておき、ヒートショックやIPTG等で蛋 白質産生を誘導できるベクターが有利であり一般に用いられている。そのなかで 最も強力でよく使われるのがPETベクターであり、最初の検討は、これから行 うことを勧める。このベクターは、T7ファージのRNAポリメラーゼとプロモー ターを利用している。このRNAポリメラーゼを大腸菌ゲノムに組みこませた菌 BL21(DE3)を通常宿主として用い、T7プロモーターを含むpETベクタ ーに産生させたい蛋白質の遺伝子を挿入する。宿主もPETベクターも市販され ているので詳しくは、カタログ等の説明を参考にすればわかりやすい。T7ブロモ 一ターは、たいへん強力なので通常1リットル培養当たり50mg前後の蛋白質が 産生される。
実際に実験をするにあたり必要なことは、大腸菌以外の蛋白質を発現させるこ とは、法的にはすべて組み換え実験となり届け出する義務がある。各研究所で安 全衛生関係の委員会に間い合わせてほしい。またDNAの操作は、PCR等の技 術の進歩や各種キット類が市販されているのでそのプロトコールに従って行えば まったく問題はなく誰にでもできる技術となっている。
蛇足になるが、S-S架橋や糖鎖のある蛋白質は、当然のことながら大腸菌で は形成されないので、酵母やバキュロウイルス等値の発現系を考えざるを得な い。さらに分泌蛋白質のシグナルペプチドの部分は、取り除かないといけない。
(2)蛋白質発現と封入体の形成の問題
強力なプロモーターを用いでもほとんど目的蛋白質の発現が、見られないこと がある。この理由のひとつは、大腸菌のアミノ酸コドンの使用頻度が他の生物、 特に動物細胞と異なるためである。N末端付近のアミノ酸コドンを大腸菌でよく 便われるコドンに置き換えることにより解決することがある。
逆に、発現レベルは高いがほとんどすべての蛋白質が不溶化して封入体を形成 することが頻繁に起こる。これには、いろいろな原因が考えられる。(1)自ら 折り畳まれて正確な空間配置をとる前に、つぎに合成されたポリペプチドが近く に来て相互作用を起こし、からまって沈殿してしまう。(2)そもそもそのポリ ペプチド単独では、foldできない。いわゆるシャペロニンの助けが必要。(3)何 らかの補助因子が必要。例えば、金属イオンを配位しなければfo1dできない蛋白質 もある。これら以外にも原因は、考えられるがよくわっかていないのが現状であ ると思う。また対症療法ができるのは、この3つ位と思われる。
(1)については、発現レベルを下げれば良いはずで、培養温度を下げたり、 プロモーターを変更することを行うだけで済む。(2)については、シャヘロニ ン等の蛋白質のfo1dingを手助けする蛋白質と共発現させる方法がある。これにつ いては、別の文献(実験医学Vol.13 No.17 pp29-33)に詳しく説明しているので そちらを参照してほしい。(3)については、不足している成分を培地に供給し でやれば、良いわけで簡単である。
しかし、これらの方法で解決できるのは、1部にすぎない。可溶性画分から目 的蛋白質を精製するのが理想ではあるが、比較的小さな蛋白質であれば、我々は ひとまずこの封入体のrefoldingを試みている。封入体は容易に精製でき、尿素や塩 酸グアニジン処理により可溶化し、希釈あるいは透析によりこれらの変成剤を取 り除くことによりもとの構造を持った蛋白質に戻すことができることがある。し かしながら、注意しなければならないのは、可溶化=正しい構造ではないことで ある。このため比活性等の生化学的手段やNMR,CD等の物理化学的手段で蛋 白質が均一な構造をとっているのか調べる必要がある。我々の経験ではrefolding の成功確率はあまり高くないが、成功すれば培養1リットルあたり100mg以上 精製できることがある。
(3)融合蛋白質として発現させる糸
目的蛋白質を可溶化画分として大腸菌で発現させる方法のひとつとして、MB P,GST,TRX等の蛋白質と融合させることが、有効であることがある。 これらの融合蛋白質を発現させるベクターも市販されているので詳しくは述べな い。これらの系の難点は、せっかく大量に発現しても目的蛋白質を切断して取り 出しさらに精製するので思いのほか量的に確保できない。また、切断にプロテア ーゼを用いるので、危険な場合がある。時に、他のプロテアーゼが狭雑して正し く切断できなかったり、その後の精製をきちんとしないとサンプルがいつの間に か切断されていることがある。さらに、もうひとつ気を使わなければならないこ とがあり、それは、融合するMBP,GST,TRX等の蛋白質がたいへん溶け やすいため可溶化画分にあっても目的蛋白質がランダムコイルのままつながって いることがある。このような場合切り出す時に不溶化したり精製中におかしな挙 動をするので多くの場合気が付く。
以上のように、ここで紹介した技術は決して珍しいものでもなく、また難しい ものではない。我々の研究室では、1つのサンプルに対して約一ヵ月でひと通り りの発現実験を行い、うまくいかなければ、次のサンプルヘ移っていくようにし ている。強力に、サンプル供給をしてくれるパートナーがいれば必要ないかもし れないが、そろそろ構造解析をする者、自らサンプル作成をしてもいい時期にき ているのではないかと思う。