
1. 偼偠傔偵
敀怓X慄傪巊偭偰弖帪偵夞愜嫮搙僨乕僞傪應掕偡傞儔僂僄朄偼丄抈敀幙寢徎拞偱婲 偙傞曄壔傪尒傞偨傔偺摦揑峔憿夝愅偺桳椡側曽朄偲偟偰拲栚偝傟偰偄傞丅側偐偱傕丄峺 慺斀墳偺恑峴偵敽偆峔憿曄壔傪儔僂僄朄偱柧傜偐偵偡傞偙偲偵偼戝偒側嫽枴偑帩偨傟偰 偄傞丅偟偐偟丄峺慺斀墳偼捠忢儈儕昩僆乕僟乕偱恑傓丅廬偭偰丄寢徎拞偱偼斀墳懍搙偑 懡彮抶偔側偭偰偄傞偲偼偄偊丄摦揑峔憿夝愅傪峴側偆偨傔偵偼偦傟偵旵揋偡傞僗僺乕僪 偱僨乕僞傪應掕偡傞偐丄斀墳懍搙傪昩丒暘丒帪娫偺僆乕僟乕偵壓偘傞昁梫偑偁傞丅峏偵丄偳偺傛偆偵偟偰弖帪偵斀墳傪奐巒偝偣傞偐偲偄偆栤戣傕偁傞丅偙傟傜偵偮偄偰偼丄崱偺 偲偙傠師偺傛偆側幚尡朄偑峫偊傜傟傞丅
(1)caged壔崌暔傪巊偆曽朄
caged壔崌暔偲偼丄椺偊偽婎幙傪壗傜偐偺曐岇婎偱廋忺偟晄妶惈偵偟偨傕偺偱丄 岝偵傛傝弖帪偵偦偺曐岇婎傪暘夝偟丄妶惈傪帩偭偨婎幙傪敪惗偝偣傞偙偲偑偱偒傞壔崌 暔偱偁傞丅偙偺傛偆側caged壔崌暔偲峺慺偲偺暋崌懱寢徎偵岝傪徠幩偡傞偲寢徎拞偱弖 帪偵婎幙偑惗惉偟丄峺慺斀墳偑奐巒偡傞丅廬偭偰丄岝徠幩偲敀怓X慄偵傛傞僨乕僞應掕 傪摨婜偝偣傞偲斀墳奐巒屻丄堦掕帪娫枅偵峺慺斀墳偑偳偺傛偆偵恑峴偟偰偄偔偺偐傪X 慄峔憿夝愅偱尒傞偙偲偑偱偒傞丅偟偐偟丄巗斕偝傟偰偄傞caged壔崌暔偼庬椶偑尷傜傟 偰偍傝丄栚揑偵偁偭偨caged壔崌暔傪崌惉偡傞偺傕忢偵梕堈偲偼尷傜側偄丅
(2)pH僕儍儞僾丄壏搙僕儍儞僾偵傛傞曽朄
峺慺斀墳偑恑峴偟側偄pH傗壏搙壓偱峺慺堦婎幙暋崌懱寢徎傪挷惢偟丄PH傗壏搙 偺僕儍儞僾傪僩儕僈乕偵偟偰斀墳傪僗僞乕僩偝偣傞曽朄丅PH僕儍儞僾偺傗傝曽偲偟偰 偼丄墫巁傗傾儞儌僯傾摍偺忲婥傪旘偽偡偐丄僼儘乕僙儖偱強掕偺pH偺娚徴塼傪棳偡曽 朄偑偁傞丅偝傜偵丄偙偺曽朄偱峺慺斀墳傪抶偔偡傞偙偲傕偱偒傞丅椺偊偽丄PH傗壏搙 傪嵟揔側傕偺偐傜彮偟偢傜偡偙偲偱梕堈偵斀墳懍搙傪1寘棊偡偙偲偑偱偒傞丅
(3)caged峺慺傪巊偆曽朄
怗攠婎傪岝暘夝惈偺婎偱廋忺偟偨晄妶惈側峺慺偲婎幙偺暋崌懱寢徎傪挷惢偱偒偨 傜岝徠幩傪僩儕僈乕偵偟偰峺慺斀墳傪奐巒偝偣傞偙偲偑偱偒傞丅
(4)曄堎懱峺慺傪巊偆曽朄
斀墳拞栤懱傪埨掕壔偡傞傛偆側曄堎傪峺慺偵摫擖偱偒傟偽丄偦偺拞娫懱偺峔憿傪 斾妑揑梕堈偵娤嶡偡傞偙偲偑偱偒傞丅
偲偙傠偱丄変乆偼嶁晹嫵庼傪戙昞幰偲偡傞廳揰椞堟尋媶乽摦揑抈敀寢徎夝愅乿偺儊 僔僶乕偲偟偰丄乽曻幩岝傪棙梡偟偨帪娫暘妱儔僂僄朄偵傛傞峺慺斀墳夁掱捛愓幚尡朄偲 僩儕僈乕偺奐敪乿偲偄偆尋媶壽戣偺傕偲偵PF偱幚尡傪峴側偭偰偒偨丅
変乆偺幚尡栚揑偼丄偳偺傛偆側幚尡傪峴側偊偽抈敀幙(峺慺)寢徎拞偱(峺慺斀墳 偵偲傕側偭偰)婲偙傞曄壔傪儔僂僄朄偱尒傞偙偲偑偱偒傞偐丄偦偺幚尡朄傪奐敪偡傞偙 偲偵偁傞丅
側偐偱傕丄斀墳傪堦惸偵奐巒偝偣傞偨傔偺僩儕僈乕偲偟偰桳 1椡側caged壔崌暔埲奜偵偳偺傛偆側僩儕僈乕偑壜擻偱偁傞偐傪 扵傞偙偲偵廳揰傪偍偄偰偄傞丅1993擭偵弶傔偰敀怓X慄偱夞 愜僷僞乕儞傪嶣塭偟偰埲棃崱擔傑偱栺8擔娫偺價乕儉僞僀儉傪 i巊偭偰幚尡傪峴側偭偰偒偨丅
偙偙偱偼偦偺娫偺幚尡宱夁偲偦偺寢壥偵偮偄偰弎傋傞丅側偍丄幚尡傪峴側偆偨傔偺僒 乽儞僾儖偲偟偰3庬椶偺垷墧嬥乽懏僾儘僥傾乕僛丄ScNP丄AP丄TH(昞1)傪巊偭偨丅偙傟 傜偺僾儘僥傾乕僛偼暘巕検傗傾儈僲巁攝楍偵慡偔憡摨惈偑 側偄偑丄怗攠僪儊僀儞偺峔憿偼僩億儘僕乕揑偵旕忢偵椙偔 帡偰偄傞(恾1)傑偨丄妶惈偵昁恵偺垷墧尨巕偵偼丄 HEXXH攝楍偲偄偆嫟捠偵曐懚偝傟偰偄傞傾儈僲巁攝楍拞偺2偮偺僸僗僠僕儞偑攝埵巕偲側偭偰偄傞丅

2. ScNP寢徎傪巊偭偨儔僂僄僨乕僞偺應掕
2.1.僀儞僸價僞乕暋崌懱寢徎偺夞愜嫮搙僨乕僞
Streptomyces caespitosus偑嶻弌偡傞僾儘僫乕僛ScNP偺寢徎偼X慄徠幩偵懳偟偰旕忢 偵埨掕偱偁傞丅傑偨丄崅暘夝擻傑偱X慄傪夞愜偡傞椙岲側抈敀幙寢徎側偺偱丄敀怓X慄 偱應掕偟偨僨乕僞(儔僂僄僨乕僞)偺幙傪挷傋傞偺偵揔偟偰偄傞丅
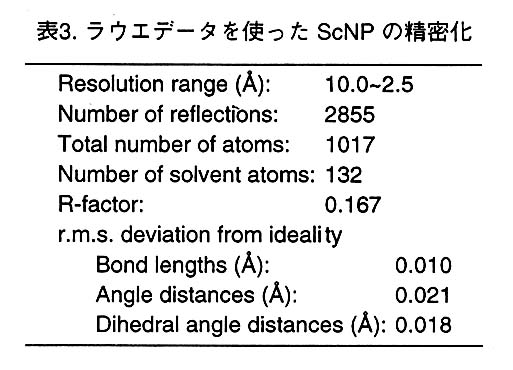
偦偙偱丄嫟寢徎朄偱摼傜傟偨僀儞僸價僞乕偲偺暋崌懱寢徎偺儔僂僄僨乕僞傪應掕偟丄 嵎僼乕儕僄恾偱僀儞僸價僞乕偺揹巕枾搙偑偳傟偔傜偄偒傟偄偵尒傞偙偲偑偱偒傞偐傪挷 傋偨丅恾2偵僨乕僞應掕偺幚尡忦審偲嶣塭偟偨儔僂僄僷僞乕儞偺堦偮傪帵偡丅僨乕僞懁 偔掕偼丄捠忢偺曽朄偱X慄僉儍僺儔儕乕偵晻擖偟偨暋崌懱寢徎偵0.5-2.0A(尒偐偗忋) 偺僶儞僪暆傪帩偮敀怓X慄傪10msec徠幩偟丄20亊40cm偺IP偵夞愜僷僞乕儞傪婰榐偟 偰峴側偭偨丅僷僞乕儞偼僇儊儔偺僗僺儞僪儖幉(冇)偵娭偟偰0-100亱傑偱10亱偍偒 偵10枃嶣塭偟偨丅偙傟傜10枃偺IP傪BAS2000偱撉傒庢傝丄僾儘僌儔儉LAUEGEN丄 LAUEN0RM丄LAUESCAL偱張棟偟丄F-data偵偟偨丅偦偺寢壥丄2.5A暘夝擻偱丄 comp1eteness偑62%丄Rmerge偑21%偲側偭偨丅扨怓X慄偱應掕偟偨僨乕僞偵斾傋偰惛搙 偼旕忢偵埆偄丅師偵丄僀儞僸價僞乕偺揹巕枾搙偑尒偊傞偐偳偆偐傪挷傋傞偨傔偵偙偺僨 乕僞偲CuK兛偱應掕偟偨native僨乕僞傪巊偭偰嵎僼乕儕僄恾傪寁嶼偟偨丅嵎僼乕儕僄恾 偼偐側傝僲僀僘偑懡偐偭偨偑丄ScNP偺妶惈晹埵偵僀儞僸價僞乕偲峫偊傜傟傞揹巕枾搙 偑懚嵼偟丄恾3偵帵偡傛偆偵儌僨儖傪抲偔偙偲偑偱偒偨丅

2.2.native寢徎偺夞愜嫮搙僨乕僞
昞2.native寢徎偺儔僂僄僨乕僞偺應掕native寢徎偐傜偺夞愜嫮搙僨乕僞偺應掕偼昞2 偵帵偟偰偁傞忦審壓偱峴側偭偨丅暋崌懱寢徎偺応崌偲偺堘偄偼丄(1)戝宆(40亊80噋) IP傪巊偭偨丄(2)敀怓X慄偺徠幩偛偲偵寢徎傪彮偟偯偮暲恑偝偣 徠幩埵抲傪曄偊偨丄偺2揰偱偁傞丅偦偺寢壥丄2A暘夝擻傑偱偺僨乕僞(F亞2冃)傪52%偺 completeness丄Rmerge=9%偱應掕偡傞偙偲偑偱偒偨丅inhibitor暋崌懱寢徎傛傝傕惛搙偺崅偄僨乕僞摼傜傟偲峫偊傜傟傞丅

IP忋偵偼怓乆側攇挿偺X慄偐傜惗偠傞夞愜揰偑婰榐偝傟偰偄傞偺偱丄奺夞愜揰偑偳 偺攇挿偺X慄偵傛傞傕偺偐傪寛掕偟偰丄嫮搙偺曗惓(wave length nomalization)傪峴側 偆昁梫偑偁傞丅偙偺曗惓偺偟偐偨偵丄堘偆攇挿偺X慄偐傜惗偠偨摨壙側斀幩偺嫮搙傪斾 妑偡傞曽朄偑偁傞丅偙偺曽朄偱偼斾妑偡傞斀幩偺悢偑懡偄傎偳惛搙偺椙偄"wave length nomalization curve偑摼傜傟傞丅ScNP偼奿巕掕悢偑彫偝偄偺偱丄彫宆IP偱偼婰榐偝傟 傞斀幩悢偑彮側偄丅偟偐偟丄戝宆P偱偼2冃埲忋偵尷偭偰傕撈棫側斀幩悢(4233屄) 偺7攞(28791屄)偑婰榐偝傟偰偄傞丅恾4偼奺攇挿枅偵婰榐偝傟偨僨乕僞偺悢偲丄偦 傟傜傪傕偲偵寁嶼偟偨wave length nomalization curve傪帵偟偰偄傞丅
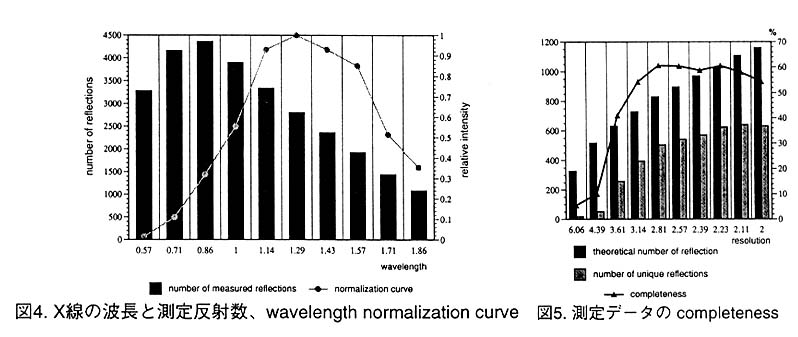
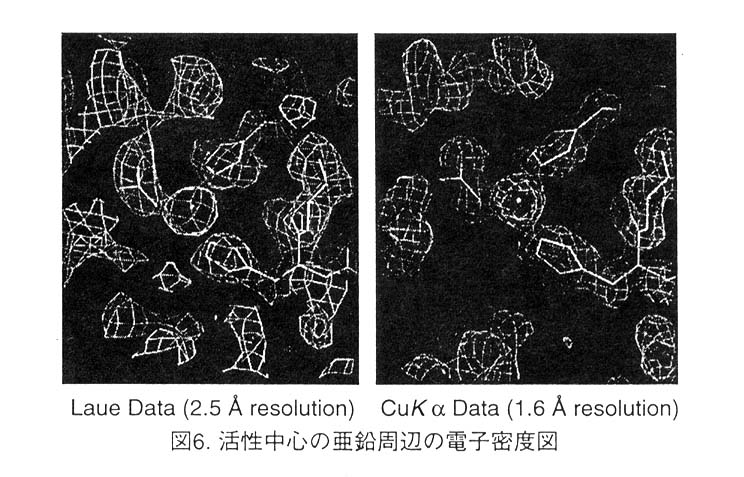
恾5偼暘夝擻枅偵丄杮棃應掕偟側偗傟偽側傜側偄斀幩悢偲幚嵺偵應掕偱偒偨斀幩悢 傪帵偟偰偄傞丅Harmonic overlap偺偨傔偵掅暘夝擻偺斀幩偺completeness偑嬌抂偵埆偄丅偙偺僨乕僞傪巊偭偰scNP偺峔憿偺惛枾壔傪PROLSQ偱峴側偭偨丅弶婜儌僨儖偼CuK兛 慄偱應掕偟偨僨乕僞傪巊偭偰1.6A暘夝擻偱惛枾壔偟偨峔憿傪巊偭偨丅惛枾壔偺寢壥 傪昞3偵帵偡丅傑偨丄恾6偼ScNP偺妶惈偵昁恵偺垷墧僀僆儞偲偦偺攝埵巕偺omit map 偱偁傞丅dompleteness偑掅偄偨傔Laue僨乕僞偱寁嶼偟偨揹巕枾搙恾偼彮偟憠偣偰偄傞 傕偺偺丄廳梫側摿挜偼偡傋偰尒傞偙偲偑偱偒傞丅
2.3.僨乕僞偺幙偺岦忋
native僨乕僞偼Rmerge偑9%偲傑偢傑偢偺惛搙偱應掕偱偒偨丅偦偺棟桼偼偡 偱偵弎傋偨捠傝偱偁傞丅偟偐偟丄completeness偑掅偄偙偲丄掅暘夝擻偺僨 堦梉偑敳偗偰偄傞偲偄偆寚娮偑偁傞丅偙傟傜傪崕暈偟偰偙扨怓X慄暲傒偺僨乕僞 傪摼傞偨傔偺曽朄偲偟偰師偺傛偆側偙偲偑峫偊傜傟傞丅
(1)棟孅偺忋偱偼丄暘夝擻dmax傑偱偺僨乕僞偑應掕偱偒偨応崌偵偼2dmax埲壓偺掅暘夝擻偺僨乕僞偼攇挿兩偲2兩偵桼棃偡傞斀幩偑廳側偭偰偟傑偆丅偦偙偱廳側偭偨斀幩偵偮偄偰deconvolution傪峴側偆丅偙傟偵傛偭偰丄掅暘夝擻偺僨乕僞傪摼傞偙偲偑偱偒傞丅
(2)崱夞應掕偟偨僨乕僞偺completeness偼4A埲忋偺崅暘夝擻偵偮偄偰傕60%埵偟 偐側偄丅偦偺棟桼偼9枃偺儔僂僄僨乕僞偼僗僺儞僪儖幉偺廃傝偵12亱枅偵嶣塭偟偰偄 傞偑丄偦傟傪傕偭偲嵶偐偔偡傞昁梫偑偁偭偨偺偐傕抦傟側偄丅傑偨丄寢徎偺orientation 傕廳梫側僼傽僋僞乕偱偁傞丅
(3)攇挿偺僶儞僪暆偼尒偐偗忋2.0-0.5A偱丄幚嵺傕偦傟偵嬤偄傕偺偲巚傢傟傞丅 僶儞僪暆偑峀偗傟偽堦夞偺敀怓X慄徠幩偱妋偐偵偨偔偝傫偺僨乕僞傪婰榐偡傞偙偲偑偱 偒傞偑斀幩偺廳側傝偲偄偆栤戣傕惗偠偰偔傞丅偦偙偱媧廂偺塭嬁傪戝偒偔庴偗傞挿偄攇 挿偺X慄傪僇僢僩偟偰僶儞僪暆偺嫹偄敀怓X慄傪巊偆曽偑丄斀幩偺廳側傝偑側偔側傞偨 傔掅暘夝擻偺僨乕僞偑摼傜傟丄寢壥偲偟偰椙偄僨乕僞偵側傞偐傕抦傟側偄丅偨偩偟丄1 枃偺IP偑僇僶乕偱偒傞媡嬻娫偑嫹偔側傞偺偱僗僺儞僪儖幉廃傝偵嵶偐偔椺偊偽偙2亱偲 偐3亱枅偵應掕偡傞昁梫偑偱偰偔傞丅
(4)Difference method(Hajdu摍)傪巊偆丅傕偟丄摨偠寢徎傪巊偭偰慡偔摨偠orientation偱帪崗t0偡傞偲IP偵偼恾7偵壓偡傛偆側慡偔摨偠僷僞乕儞偱嫮搙 暘晍偩偗偑傢偢偐偵堎側偭偨夞愜憸偑婰榐偝傟傞丅恾7偺 側偐偱丄F兩1(hkl)t0偲F兩2(hkl)t0偼帪崗t0偺堎側傞攇挿兩1偲兩2偵桼棃偡傞摨壙側斀幩偲偡傞丅

捠忢偼wave length nomalization curve傪巊偭偰偙傟傜傪僗働乕儖崌傢偣偟丄暯嬒偟偰巊偆丅偟偐偟丄帪崗t0丄t1偺僨乕僞偐傜寁嶼偟偨曄壔棪仮F(hkl)兩1丄t1偲仮F(hk1)兩2丄t1偼僗働乕儖崌傢偣傪偡傞昁梫偑慡偔側偔偰扨弮偵暯嬒偡傞偙偲偑偱偒傞丅傑偨丄媧廂偺塭嬁側偳傕斾傪寁嶼偡傞偲偒偵慡偔僉儍儞僙儖偝傟偰偟傑偆丅偙偺曽朄偼帪崗t0偲t1偺偙峔憿偺曄壔傪尒傞偨傔偺嵎僼乕儕僄恾偺學悢傪媮傔傞偨傔偺桳岠側曽朄偱偁傞丅
3.摦揑峔憿夝愅偺偨傔偺梊旛幚尡
3.1.caged僾儘僩儞傪巊偭偨pH僕儍儞僾
ScNP偺寢徎偼pH8晅嬤偱摼傜傟傞偑丄PH傪7埲壓偵壓偘傞偲傂傃偑擖偭偰夡傟偰偟傑偆丅偦偙偱丄ScNP寢徎偵caged僾儘僩儞(恾8)傪soaking偟丄儗乕僓乕岝慄傪徠 幩偡傞偙偲偵傛偭偰僾儘僩儞傪敪惗偝偣寢徎偺pH偑壓偑偭 偨偐偳偆偐傪丄寢徎偑夡傟偨偐偳偆偐儔僂僄僷僞乕儞傪堦掕 帪娫枅偵嶣塭偟偰僠僃僢僋偟偨丅
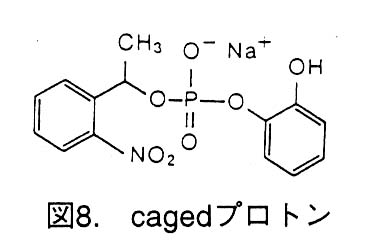
偟偐偟丄8暘栤偵25枃偺儔僂僄僷僞乕儞傪IP偵婰榐偟偨偑僷僞乕儞偼尦偺傑傑偱丄壗偺曄壔傕惗偠側偐偭偨丅偙偺尨場偲偟偰caged僾儘僩儞偑儗乕僓乕偱岠棪椙偔暘夝偝傟側偐偭偨偙偲偑峫偊傜傟傞丅傑偨丄暘夝偝傟偰傕抈敀幙偺暘庤昞柺偵偼巁惈丒墫婎惈傾儈僲巁巆婎偑偨偔偝傫偁傞偺偱丄偦傟傜偺娚徴嶌梡偱pH偑巚偭偰偄偨傎偳壓偑傜側偐偭偨偲傕峫偊傜傟傞丅
3.2.忲婥奼嶶傪棙梡偟偨pH僕儍儞僾
忲婥奼嶶偱pH偳傟偔傜偄曄壔偡傞偐傪挷傋傞偨傔偵丄僈儔僗娗偺拞偵悈偲墫 巁傪恾9偺傛偆偵嫟懚偝偣偰墫巁偺忲婥傪悈偺曽偵旘偽偟丄堦掕帪娫枅偵悈偺pH傪 挷傋偰傒偨丅偐側傝戝傑偐側幚尡偱偼偁傞偑丄寢壥偼墫巁偺擹搙傪揔摉偵慖傋偽寢徎 偺pH傪偁傞掱搙朷傒偺抣偵帩偭偰偄偗傞壜擻惈傪帵偟偰偄傞丅
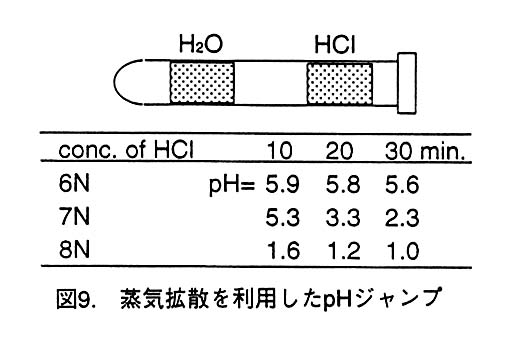
偦偙偱丄ScNP寢徎傪僈儔僗僉儍僸儔儕乕偵擖傟丄寢徎偐傜栺2cm棧傟偨偲偙傠偵 6N墫巁傪抲偒(帪崗t=0暘)丄敀怓X慄偱夞愜嫮搙僨乕僞傪應掕偟偨丅10msec偺X 慄徠幩偲P岎姺傪偮偓偮偓偵峴側偄側偑傜丄t:1暘17昩偐傜30暘58昩偵偐偗偰15 枃偺II)偵偍傛偦1.5暘娫妘偱夞愜嫮搙僨乕僞傪婰榐偟偨丅偙偺帪揰偱應掕傪堦帪拞抐 偟丄岺P忋偵婰榐偝傟偨夞愜揰偺宍側偳偑偳偆曄壔偟偰偄傞偐傪BAS2000偱撉傒崬傑偣 偰挷傋偨丒僗僩儕乕僋傪堷偔摍偺曄壔偼尒傜傟側偐偭偨丅偦偙偱應掕傪嵞奐偟丄40暘 58昩(4HCLLaue20)丄47暘58昩(4HCLLaue21)丄54暘14昩(4HCLLaue22)偵偦傟 偧傟10msec偺X慄徠幩傪峴側偭偰偼BAS2000偱夞愜揰偺曄壔傪挷傋偨丅4HCLLaue20 偱偼彮偟僗僩儕乕僋傪堷偒偩偟偰偄傞丅4HCLLaue23偱偼姰慡偵寢徎偑偩傔偵側偭偰偟 傑偭偨偺偱應掕傪廔椆偟偨丅奺儔僂僄僷僞乕儞傪斾妑偟偰傒傞偲夞愜揰偺嫮搙暘晍偑曄 壔偟偰偄傞偙偲偑傢偐傞丅偙偺曄壔偑pH掅壓偵傛傞ScNP暘巕偺峔憿曄壔傪斀塮偟偰 偄傞傕偺偱偁傟偽嫽枴怺偄丅偙偺幚尡偱偼丄奺帪娫枅偺僨乕僞偼寢徎偺曽埵傪偄傠偄傠 曄偊偰應掕偟偰偄側偄偺偱堦斣椙偄傕偺偱傕Rmerge偑16%丄completeness偼10%掱搙 偱偁偭偨丅偙偺忲婥奼嶶傪棙梡偡傞曽朄偼寢徎偺pH偑偄偔傜偵側偭偨偐丄尩枾偵偼傢 偐傜側偄偲偄偆寚揰偑偁傞丅偟偐偟丄旕忢偵娙扨偵偱偒傞偺偱栚揑偵傛偭偰偼棙梡壙抣 偑偁傞偲峫偊傞丅
3.3.僼儘乕僙儖傪巊偭偨pH僕儍儞僾
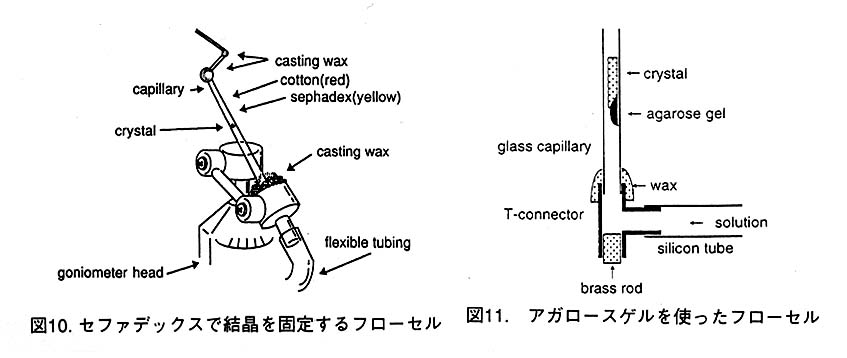
忲婥奼嶶偵懳偟偰僼儘乕僙儖偱偼強掕偺pH偺梟塼傪棳偡偙偲偑偱偒傞偺偱尩枾偵 pH傪僐儞僩儘乕儖偡傞偙偲偑偱偒傞丅偦偙偱丄恾10偺傛偆側僼儘乕僙儖傪巊偭偰傒偨丅 偟偐偟丄偙傟偱偼.(1)寢徎偑僙僼傽僨僢僋僗拞偵杽傕傟偰偄傞偨傔偵僇儊儔偵僙僢僩偟 偰傾儔僀儊儞僩傪偡傞偲偒偵傎偲傫偳尒偊側偄丄(2)X慄傪徠幩偟偨偲偒僙僼傽僨僢僋 僗偺僶僢僋僌儔儞僪偑旕忢偵戝偒偄丄(3)僙僼傽僨僢僋僗偑枾偵媗傑傝夁偓傞偲梟塼偑 棳傟偵偔偔丄媡偵媗傑傝嬶崌偑慹偄偲梟塼傪棳偟偨偲偒偵摦偔摍偺寚揰偑偁傝巊偄偵偔 偐偭偨丅傑偨丄僌儕乕僗傗儚僙儕儞偱寢徎傪屌掕偟偰傒偨偑廫暘側傕偺偱偼側偐偭偨丅 偮偓偵丄恾11偵帵偡傛偆側僼儘乕僙儖傪嶌傝丄寢徎傪掅梈揰傾僈儘乕僗僎儖偱屌掕偟 偨丅傑偩夵椙偺梋抧偑偁傞傕偺偺丄偙傟傑偱偺偆偪偱嵟傕巊偄傗偡偄丅偨偩丄傾僈儘乕 僗偼崅擹搙偺墫傗PEG偑娷傑傟偰偄傞偲梟偗側偄偺偱偳傫側応崌偱傕巊偊傞偲偄偆栿 偵偼偄偐側偄丅傾僈儘乕僗偺戙傢傝偵傾僋儕儖傾儈僩僎儖傕桳朷偱偼側偄偐偲峫偊偰偄 傞偑丄傑偩帋偟偰偄側偄丅恾11偺僼儘乕僙儖拞偵僒堦儌儕僔儞偺寢徎傪傾僈儘乕僗僎 儖偱屌掕偟丄EDTA傪娷傓梟塼傪棳偟偰傒偨丅栚揑偼僒乕儌儕僔儞拞偺妶惈偵昁恵偺垷 墧尨巕偑EDTA偱敳偐傟偰偄偔條巕偑尒傜傟傞偐偳偆偐偱丄僨乕僞偺幙傪専摙偡傞偨傔 偱偁傞丅梟塼傪棳偟偼偠傔偰0丄30丄45暘屻偵僨乕僞傪應掕偟偨丅completeness傪忋偘 傞偨傔偵摨偠幚尡傪X慄偵懳偡傞曽埵傪曄偊偨3屄偺寢徎傪巊偭偰峴側偭偨丅偟偐偟丄 2屄偺寢徎偼夞愜嫮搙偑庛偔偰張棟偡傞偙偲偑偱偒側偐偭偨丅1屄偺寢徎偐傜偺僨乕僞 偱偼暘夝擻2A偱completeness偼30%掱搙丄Rmerge偼22-28%偱偁偭偨丅傑偨丄 ScNP寢徎傪巊偭偨幚尡偱偼梟塼傪棳偟側偑傜丄僗僺儞僪儖幉偑0丄24丄48亱偱僨乕僞 (image-1丄image-2丄image-3)傪應掕偟偨丅
偙傟傜偺僨乕僞傪張棟偟偨偲偙傠丄椺偊偽image-1偩偗偩偲completeness偼29%( 2.0A暘夝擻)偲掅偄偑丄Rmerge偼16%掱搙偱偁偭偨丅偟偐偟丄image-1 + image-2丄 image-1 + image-2 + image-3偲偄偆嬶崌偵寢徎偺曽埵傪曄偊偰偲偭偨僨乕僞傪偩偟崌傢 偣傞偲Rmerge偼23%丄29%偲偳傫偳傫埆偔側偭偰偄偭偨丅柧傜偐偵媧廂偺塭嬁偑偱 偰偄傞丅
4.敀怓X慄偵傛傞僟儊乕僕
敀怓X慄傪巊偭偨幚尡偑偆傑偔峴偔偐偳偆偐偺嵟弶偺尞傪埇偭偰偄傞偺偼X慄偵懳 偟偰寢徎偑埨掕偱偁傞偐偳偆偐偱偁傞丅変乆偼摨偠傛偆偵嶌偭偨偮傕傝偺寢徎偱傕丄偁 傞僶僢僠偺寢徎偼椙岲偱偁傞偺偵暿偺僶僢僠偺寢徎偼僗僩儕乕僋傪堷偔傕偺偽偐傝偱偁 傞偲偄偆偙偲傪宱尡偟偰偄傞丅偟偐偟丄僗僩儕乕僋傪堷偔僶僢僠偺寢徎偱傕BL6A偱扨 怓X慄傪徠幩偟丄夞愜憸傪挷傋偰傒傞偲壗偺栤戣傕側偐偭偨丅壖愢偱偼偁傞偑丄偙偺傛 偆側偙偲偑婲偙傞尨場偲偟偰師偺傛偆側偙偲傪峫偊偰偄傞丅偡側傢偪丄寢徎帺恎偵僒儞 僾儖偺弮搙偑埆偐偭偨丄寢徎偑偱偒傞僗僺乕僪偑懍偡偓偨丄PF傊帩偭偰偄偔搑拞偱偺 壏搙曄壔傗怳摦摍偺偨傔偵壗傜偐偺寚娮偑惗偠偰偟傑偭偨丅偦偺傛偆側寢徎偵敀怓X慄 傪徠幩偡傞偲(懡暘丄擬偺偨傔偵)愥曵傪偆偮傛偆偵寢徎偑夡傟偰偟傑偆丅偪側傒偵丄 幚尡傪奐巒偟偨摉弶偼僗僩儕乕僋傪堷偔寢徎偽偐傝偺僶僢僠偐傜丄敿擔埵宱偮偲椙岲側 夞愜揰傪帵偡寢徎偑尰傢傟偰偒偨偲偄偆偙偲偑偁偭偨丅偙傟偼堦掕帪娫偺宱夁偲偲傕偵 寚娮傪夞暅偟丄姰慡惈傪庢傝栠偟偨偐傜側偺偐傕抦傟側偄丅媡偵慡偔夞暅偟側偐偭偨偙 偲傕偁偭偨丅
忲婥奼嶶朄偱寢徎傪嶌傞偲丄僉儍僺儔儕乕偵晻擖偡傞偲偒偵巊偆曣塼偲寢徎偑惉挿 偟偨僪儘僢僾偺慻惉偼姰慡偵摨偠偱側偄丅偦偺偨傔偵寢徎傪庢傝埖偆偲偒偵寢徎傪彎傔丄扨怓X慄偱偼栤戣偵側傜側偔偰傕丄敀怓X慄偱偼抳柦揑偵側傞偙偲偑偁傞偐傕偟傟側偄丅 廬偭偰丄儔僂僄幚尡偺偨傔偺寢徎偼摟愅朄偱峴側偄丄摟愅奜塼(昁梫側傜彮偟捑揵嵻擹 搙傪忋偘偨曣塼偵摟愅偟偰偐傜丄偦傟傪)傪巊偭偰丄寢徎傪庢傝埖偆偺偑椙偄偐傕偟傟 側偄丅
僗僩儕乕僋偺尨場偑敀怓X慄傪巊偭偨偲偒偵惗偠傞擬偵偁傞側傜偽丄挿偄攇挿偺X 慄傪僇僢僩偟偨傝媧廂斅傪擖傟偰X慄偺嫮搙傪庛傔傞偺偑偄偄偐傕抦傟側偄丅Moffat傜 偺寁嶼偵傛傞偲NSLS偺BL X26C偺敀怓X慄(1.7-0.7侌)傪100msec抈敀幙寢徎偵 徠幩偡傞偲丄X慄偑摉偨偭偰偄傞晹暘偱偼8.5亷丄偦偺棤懁偱傕7.3亷偺壏搙忋徃偑偁 傞丅偟偐偟丄擬偵傛偭偰惗偠傞儌僓僀僋惈偺憹戝偼丄摨偠100msec偱傕(10msec偺徠 幩廫90msec偺媥宔)傪10夞孞傝曉偡偲偄偆徠幩曽朄偱梷偊傞偙偲偑偱偒偨丅偡側傢偪丄 90msec偺媥宔偺栤偵擬偑寢徎拞傪奼嶶偟丄嬊強揑側壏搙忋徃傪杊偖偙偲偵傛偭偰僟儊 乕僕傪梷偊傞偙偲偑偱偒偨偲偄偆偙偲偱偁傞丅傑偨丄Sweet傜偼僩儕僾僔儞偺僨乕僞應 掕傪1.5mm偺僌儔僼傽僀僩僼傿儖僞乕偱攇挿偺挿偄X慄傪僇僢僩偟偨敀怓X慄偱峴側 偄丄寢徎偺庻柦傪偐側傝拠偼偡偙偲偑偱偒偨偦偆偱偁傞丅幚嵺偵偙偺岤傒傪帩偭偨僌儔 僼傽僀僩(傾儖儈偱偼135兪m偵憡摉偡傞)偼丄1侌偱40%埵丄1.5A偱80%丄2A偵 側傞偲97%偺擖幩X慄傪媧廂丒僇僢僩偡傞丅偝傜偵丄嫮偄敀怓X慄傪抁帪娫(100 msec)徠幩偡傞傛傝傕丄庛偄敀怓X慄傪挿帪娫(4sec)徠幩偟偰僨乕僞傪應掕偟偨傎偆 偑1屄偺寢徎偐傜偨偔偝傫偺夞愜幨恀傪嶣塭偡傞偙偲偑偱偒偨偲曬崘偟偰偄傞丅
摉慠偺偙偲側偑傜丄擬偵傛傞寢徎偺僟儊乕僕偼椻媝偵傛偭偰偐側傝杊偖偙偲偑偱偒 傞偲摨帪偵丄斀墳懍搙傪棊偡偙偲偑偱偒傞丅椺偊偽丄幒壏偱丄18kcal mol-3偺妶惈壔僄僱儖僊乕偑昁梫側斀墳偺斀墳懍搙偼200K偺壏搙傪壓偘傞偙偲偱丄幒壏傛傝6寘斀墳懍丄搙偑抶偔側傞丅
埲忋丄僟儊乕僕偵娭偡傞偙偲偼偙傟傑偱偺宱尡偐傜偺乬姶怗乭偵婎偯偄偰偄傞偺偱 娫堘偭偨晹暘傕偁傞偩傠偆丅偟偐偟丄尰帪揰偱偼椙偄僨乕僞傪應掕偡傞偨傔偺曽朄偲偟 偱寢徎偺栤戣傪彍偔偲丄
嵟屻偵丄偙偺巇帠偼嶁晹嫵庼傪戙昞幰偲偡傞廳揰椞堟尋媶乽曻幩岝偵傛傞抈敀幙寢 徎峔憿偺儈儕昩僆乕僟乕偺僟僀僫儈僢僋僗偺尋媶乿偺傕偲偱丄崅僄僱儖僊乕暔棟妛尋媶 強曻幩岝幚尡巤愝BL18B偵愝抲偝傟偰偄傞憰抲傪巊偭偰峴側傢傟偰偒偨傕偺偱偁傞丅 PF偱幚尡偡傞偵偁偨偭偰偼嶁晹嫵庼丄搉绮攷巑偵偼懡戝偺偛墖彆丒偛巜摫傪捀偄偨丅 傑偨丄偙偺巇帠偼尨揷偑戝嶃戝妛岺妛晹偵嵼擟拞偺1993擭傛傝僗僞乕僩偟偨偑丄1994 擭偵搶嫗戝妛栻妛晹偵揮擟偟偨屻傕戝嶃戝妛岺妛晹峛斻尋媶幒偺戝妛堾惗丄孖惒尮巏孨 偲悪杮柧巕偝傫偺嫤椡傪摼偰峴側傢傟偨傕偺偱偁傞丅