
1. はじめに
細胞には、複数種のサイクロフイリン(CyP);細胞質型のCyPAと膜結合型のCyPB が共存し、互いのアミノ酸配列には類似性がある。そのin vitroの酵素活性は、ポリ ペプチドのプロリンのアミド結合のシスからトランスヘの異性化の活性(PPIase活 性)を示す。取り上げるCyPは、すべての生物細胞に大量に存在する蛋白質であり、 生命活動の維持、保全に不可欠な機能を果たすと考えられるに係わらず、その生理 学的な役割分担は未だ結論が得られていない。in vitroで自然に元に戻るいくつかの 蛋白質が、CyPAの付加によりリフォールディンクが促進されることからフォール ディングに関与することを示唆するグループがある。しかしCyPが欠けた酵母菌の ミュタント株が正常に成育する事より、CyPがフォールディングに関与しないこと を示す。CyPのin vitroの働きと繋がりを示す報告は、ショウジョウバエの視細胞で、 サイクロフィリンのホモログであるニナAのミュタント.の種は、ロドプシンを構成 するR1が、視細包の表面に運ばれず、小胞体に蓄積する。このR1は、ホールディ ングは完成してはいるが、本来あるべき部位に運ばれず、ニナAは輸送経路に関与 し、フォールディングには関与しないことが報告された[1]。Lubanらは、CyPAがヒ ト免疫不全ウイルス(HIV-1)のGag前駆蛋白質に直接結合するが、CyPBはHIV-2 とsimian immunodeficiency virus(SIV)のGag前駆蛋白質に結合することを報告した [2-4]。更に、HIV-1のp55gagのカプシド蛋白質のプロリンリッチな領域がCyPAとの結合を支配することを見いだした。
生物細胞に共通に存在し、且つ生命維持にある面で不可欠の生理現象において本 質的な働き持つものとしてセルサイクルの静止(Go)に保つ過程と耐熱応答からの 回復過程がある。筆者は、細胞質型CyPAは前者の過程に、膜結合型CyPBは後者の 過程に関与するのではないかとの予測のもと研究を進めている。
細胞が、通常の状態からずれた環境におかれた時、(例えば、細胞内の疎水性が 変わる、温度が上昇する)タンパク質のループにおいてその両端は固定されている が歪んだ構造をとるとするとCyPのリガンド結合部位に認識されて付き、その構造 が保持される。元の状況に戻った時リガンドが離れる。このような機構でCyPが働 くとするとこれまでCyPに結合したリガンドが見いだされないことを説明する。
すでに報告した大腸菌の細胞質型サイクロフィリンA(e-CyPA)とトリペプチド (suc-Ala-Pro-Ala-pNA)の複合体の1.8Å分解能の結晶構造[5]と酵母菌の細胞質型サ イクロフィリンA(y-cyPA)の1.9A結晶構造についてまとめ、cyPのペプチド結合サ イトに付く機構について議論する。
2. 実験と方法
大腸菌のe-CyPAとトリペプチド(Suc-Ala-Pro-Ala-pNA)の複合体の結晶は、トリペ プチドをメタノールに溶かし、O.5mM蛋白質、6mMトリペプチド、10%メタノー ル、30%飽和硫安を含むトリス塩酸緩衝液(PH8.O)の10μlのドロップを46%飽和 硫安を含むトリス塩酸緩衝液に対して20℃でhanging drop蒸気拡散法により平衡 にして得た。種結晶法で更に大きく成長させた。トリペプチドのシスのプロリンの 周りは特に、メタノールに囲まれて水がはずれやすく、また、蛋白質の疎水性の領 域もメタノールが配位するので水がはずれやすくなり、トリペプチドが蛋白質に付 いたと思われる。
結晶は、斜方晶系に属し、空間群P212121,a=66.33Å,b=68.23Å,c=40.03Å, Z=1,Dc=1.203g/cm3,Vm=2.43A3/Da,Vso1:49.4%である。
それぞれ1mM HgCl2(18時間)、O.5mMK2PtCl4(3日間)、SmCl3、の飽和溶液 (3日間)を含む55%の硫安溶液に母結晶を浸潤させ3種の重原子誘導体を得た。母 結晶と重原子誘導体の反射強度は、高エネルギー物理学研究所の放射光を線源(波 長は1.00Å)とし、ビームラインBL6Aに備えられた高分子用ワイセンベルグカメ ラを用いて収集した。位相は多重同型置換法によりPROTEINで解析し、2.5Å分解 能でFigure of Meritは、O.73となった。IRISワークステジョンでCHAINとOプログ ラムで分子構築を行ない、XPLORプログラムにより精密化し最終的に、5.0から1.8 Åの12783の独立な反射(測定可能な反射数の79%)に対しR=17.6%に収束した。 酵母菌のy-CyPAの結晶は、ポリエチレングリコールを沈殿剤としたトリス塩酸緩 衝液(PH8.O)を用いて、20℃でhanging drop蒸気拡散法により得、更に種結晶法に より結晶を大きく成長させた。
結晶は、三斜晶系に属し、空間群P1, a=44.45(2)Å, b=53.11(2)Å, c=32.018(6)Å, α=84.91(2)゚、β=95.22(4)゚,γ=108.56(4)゚,Z=2,Dc=1.21g/cm3,Vm=2.07A3/Da,Vsol=40.6%である。
母結晶の反射強度の収集は、放射光を線源とし65303個の観測データに対し Rmerge=4.7%となった。ヒト細胞質型サイクロフイリン(h-CyPA)161をサーチモデル. として分子置換法によりXPLORプログラムで解析した結果、最適の2分子の rigid-bodyの精密化はR因子=34%を与えた。Oで分子構築を行ない、XPLORによる 精密化は、最終的に、5から1.9Åの17931個(測定可能な反射数の85.8%)の独立な 反射に対しR=17.6%と成った。
3. 細胞質型サイクロフイリンA(e-CyPA,y-CyPA)の全体構造
3次元構造を基に並べた大腸菌、酵母菌、ヒト由来細胞質CyPA(e-CyPA, y-CyPA,h-CyPA)と膜結合型CyPB(e-CyPB,y-CyPB,h-CyPB)のアミノ酸配列を図 1に示す。ヒトh-CyPAは、5個のエキソンと4個のイントロンから成る。h-CyPA との相同性は、哺乳類では95%以上と高く、y-CyPBとは60%で、e-CyPAでも27% に保たれている。細胞質CyPAと膜結合型CyPBの相同性は、大腸菌で54%,酵母菌 56%,ヒト65%である。

図1.ヒト、酵母菌、大腸菌の細胞質型CyPAと膜結合型CyPBのアミノ酸配列。 ハイフンは欠失、影文字はリガンド結合サイト、太文字は同じアミノ酸であるこ とを示す。矢印はh-CyPAのエキソンの境界である。
e-CyPAとy-CyPAの全体の構造は(図2)、1次のアミノ酸配列から予想される通 り、構造の骨格は同じである。両者とも8本の逆平行のβストランドがβバーレル 構造を構成し、βバーレルの蓋をするように上下をαヘリクスが占める。βバーレ ルは、4本の逆平行のβストランドから成る2枚のβシートが直交して重なる。細 胞質型h-CyPA161と膜結合型h-CyPB171の全体の構造とも同じである。
結晶学的に独立な2個の分子y-CyPA間のアミノ酸残基Cαを重ねた時のCαを原子間のずれの平均r.m.s.は、0.25Åであり、y-cyPAとh-cyPAの対応するアミノ酸残基とのそれは、0.38Aであり3次元構造が完全に保存されている。
e-CyPAは、y-CyPAの骨格をなす8本のβストランドと2本のαヘリックスを構成 する75個のアミノ酸残基のCαの原子間のずれの平均は、0.67Åで良く重なってお り、同じ基本的構造を持つ(図3)。
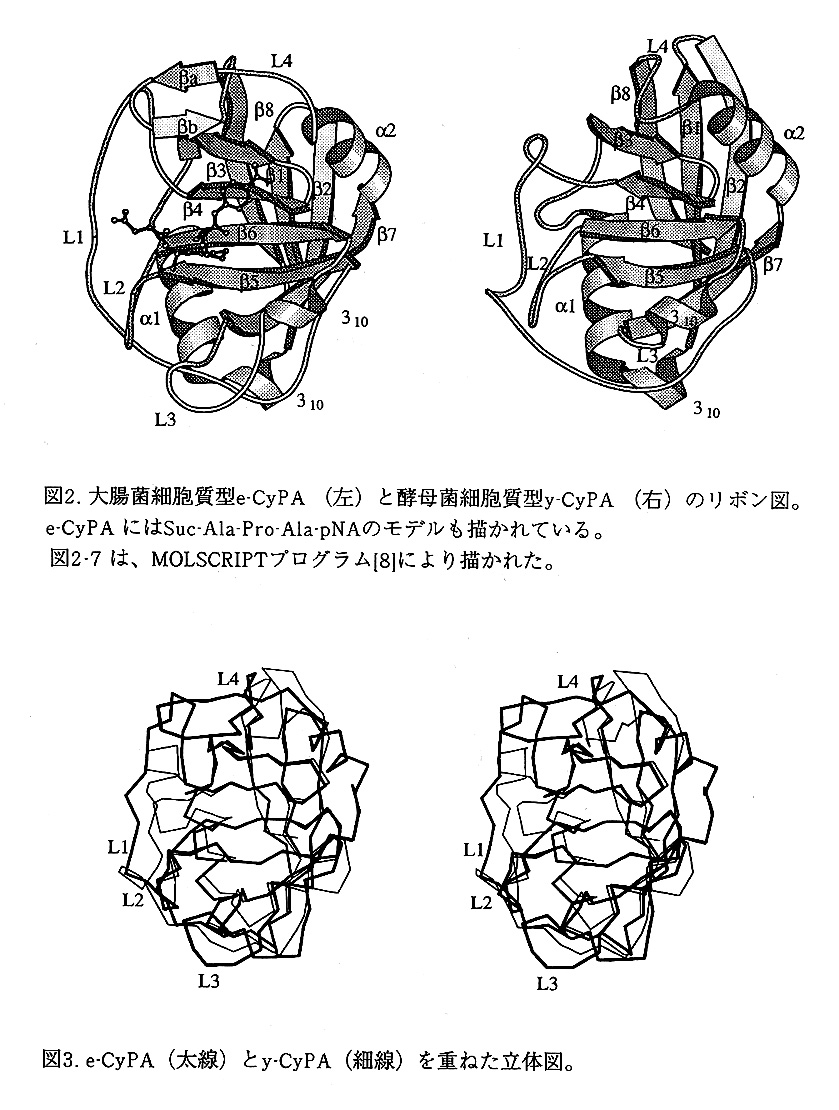
e-CyPA,y-CyPA,h-CyPAは、すべて上側のβシート(β3,β5,β6,β5ストランド) の表面は、ペプチドの結合サイトを作る。一方、下側のβシート(β8,β1,β2,β7 ストランド)は、上側のβシートとの疎水性相互作用によりβバーレル構造を安定化 させる。更に、2本のαヘリクスが全体の構造の安定化を補強する。
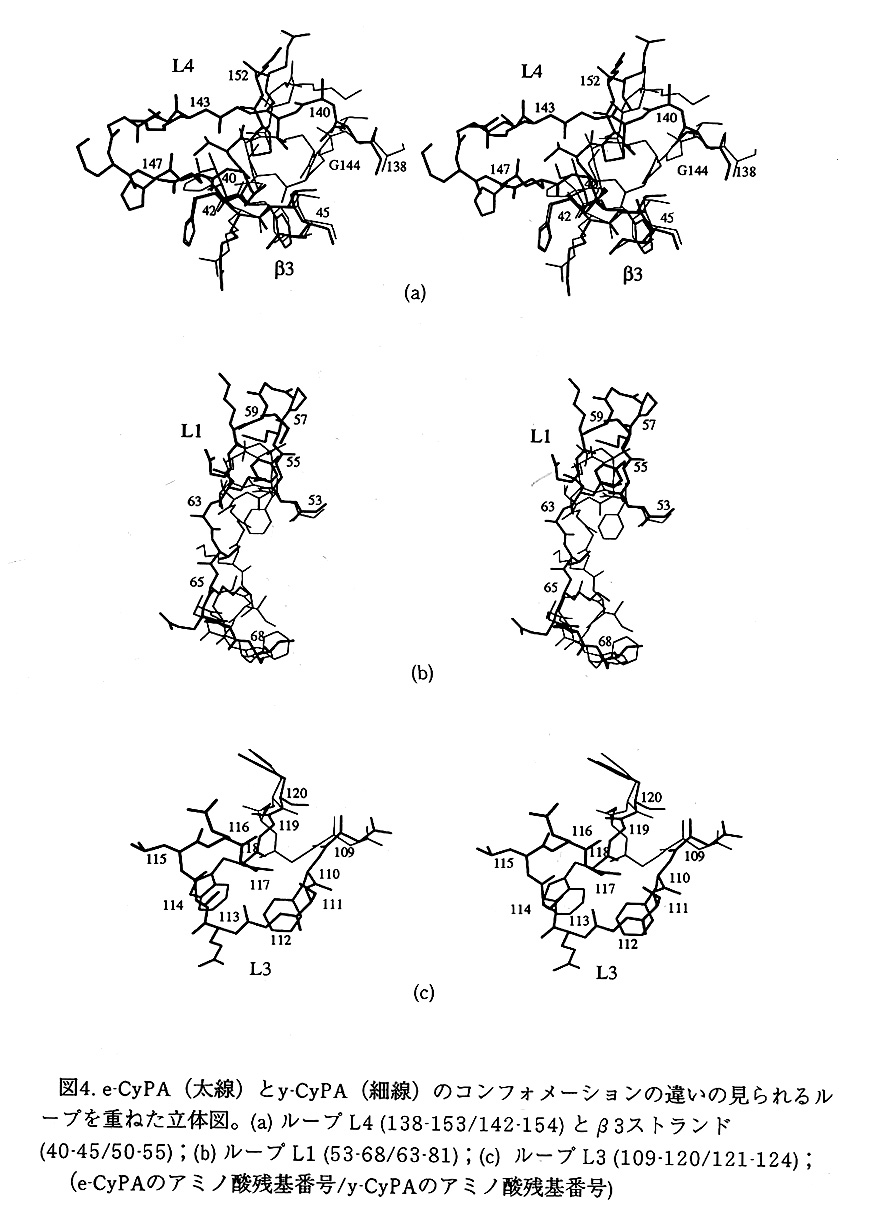
e-CyPAは、上側のβシートの周辺にあるL1,L3,L4のループとα1とβ3を結ぶル ープのコンフォメーションにおいてy-CyPA,h-CyPAに対し違いが見られる(図4)。 e-CyPAのL3とL4ループにおけるアミノ酸配列の挿入とL1ループにおける欠失がコ ンフォメーション変化をもたらす。また、e-CyPAにおいて、β1とβ2のストランド が短いのは欠失により生じる。e-CyPAのα2に続くL4ループは、β3ストランドから 遠ざかったコースを通ってターンしβリボンを作る。このコンフォメーションは、 ヒト膜結合型h-CyPBにも見られる。e-CyPAのAla140に対応する位置にy-CyPA, h-CyPAでは、側鎖のないグリシンがあり(それぞれGly144,Gly146)、β3と立体障害 を生じない。h-CyPBでは側鎖のあるリジンが占め、L4ループは、e-CyPAに似たコ ンフォメーションを取る。e-CyPAのL1ループは、L4ループのβリボンのHis147、 β3のIle40, His42とPhe55, Pro57, Met59との疎水性の相互作用を通して密にパッ キングするようなコンフォメーションをとる。Ser111からTrp118の8個のアミノ 酸残基の挿入を持つe-CyPAのL3ループは、その部分のみを分子の表面に突き出して いる。
4.ペプチド結合サイト
e-CyPA,y-CyPA,h-CyPAは、すべて上側のβシートの表面にβストランドに平行
に走る溝がある。この溝には、疎水性のアミノ酸残基で囲まれたポケットがある。
y-CyPAにおいては、5個のアミノ酸残基の疎水性の側鎖(Phe58,
Met59, Trp119, Leu120, His124)がポケットの壁を形成し、底をPhe111が占める(図5)。Phe58,
Met59は、β3とβ4のタイプIIのβターンに位置し、嵩高なPhe58,
Met59はβバル ジ様構造を持ち、βシートの同じ側を向く。また、嵩高いTrp119,
Leu120 は1タ ーン310ヘリックスのC末を占める。Leu120の主鎖のカルボニル基は、β7スト
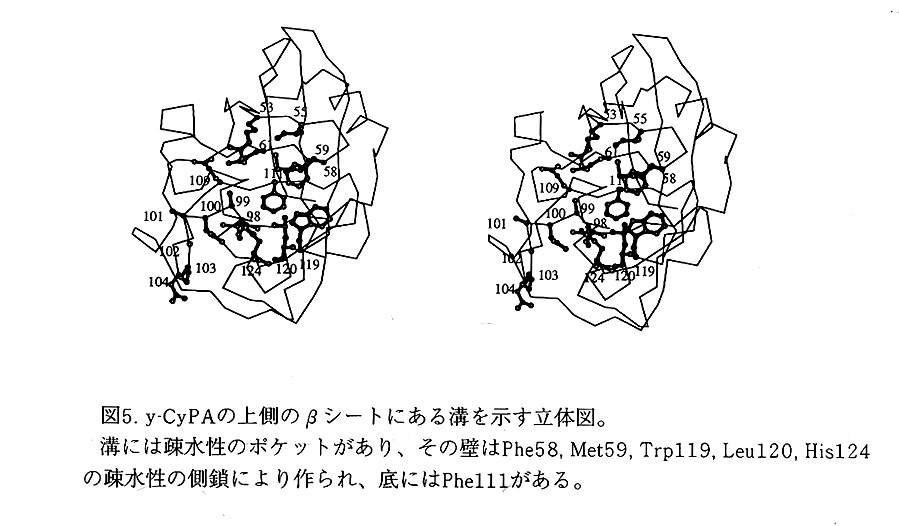
ランドの1つ前にあるHis124の主鎖のアミドのNHと水素結合を作る。His124の 側鎖のNHは、Met98の主鎖のカルボニル基と水素結合を作り、側鎖の芳香環が表面 に対し垂直に固定される。Phe58, Trp119, Phe111の側鎖の芳香環は、蛋白質の表面 に平行な配向を取る。h-CyPAにおいもこの疎水性のポケットは、同じアミノ酸残基 (Phe60, Met61, Trp121, Leu122, His126, Phe113)が同じ位置を占め、同じ配向 を取る。
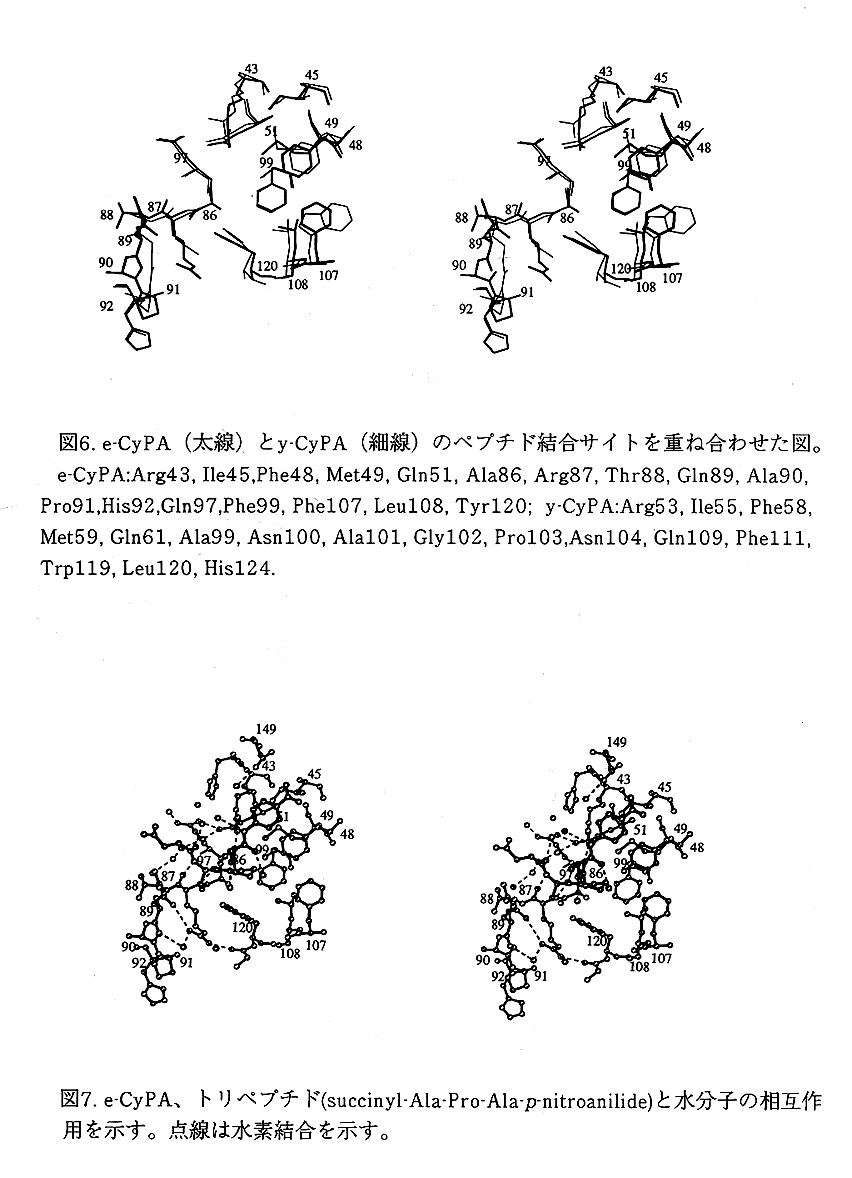
e-CyPAでも、上側のβシートの表面の溝に疎水性のポケットがある。同様に5個 のアミノ酸残基の疎水性の側鎖(Phe48, Met49, Phe107, Leul08, Tyr120)が壁を作 り、Phe99が底にある(図6)。Phe48とMet49は、βバルジ様構造を持ち、βシー トの同じ側を向き、Phe107とLeu108は1ターン310ヘリックスのC末を占める。 Tyr120の主鎖のアミドのNHは、Leu108の主鎖のカルボニル基と水素結合を作り固 定化されている。Tyr120の側鎖の芳香環は、フェニル基の水酸基を溶媒に晒すよう に分子面に対し垂直に立ち上がる。一方、Phe48, Phe107, Phe99 の側鎖の芳香環は 分子面に平行に並ぶ。
真核生物で保存されているトリプトファンとヒスチジンが大腸菌ではフェニルア ラニンとチロシンに変異しているけれども、`疎水性ポケットを形成するアミノ酸残 基の側鎖は、すべて同じ配向を持つ。これらのアミノ酸残基は酵母菌からヒトに至 るすべての真核生物のCyPAで保存されていることより、これらの配向は、原核生物 と真核生物のすべてのCyPAで保存されていると思われる。
5.トリペプチドと疎水性のポケットの相互作用
e-CyPAとトリペプチド(Suc-Ala-Pro-Ala-pNA)の複合体の構造において、トリペプ チドはシス異性体の形でプロリンの5員環をTyr120の側鎖に平行にして疎水性のポ ケットに挿入して付いている(図7)。Arg43のNη2は、トリペプチドのPro2の主 鎖のカルボニル基と水素結合を作る。Arg43のNη1は、Pro2の主鎖のC=Oをまっす ぐ伸ばしてOから3.21Åに位置し、Asp149の側鎖に水素結合する水分子から3.31Å 離れている。Arg43のNεは、Gln51のOε1から3.09Åにある。Arg43の側鎖のグ アニディン環は、Ile45とPhe48の疎水性の側鎖とトリペプチドのアニリン環に囲ま れており、イオン化されておらず、電荷的に中性である。Arg43,Gln51,Gln97の 側鎖は、水素結合のネットワークをつくる。このネットワークは、86から88の残 基の主鎖と平行に走り、トリペプチドのプロリンのN米側が占める溝を作る。この Arg87の主鎖がトリペプチドのAla1の主鎖と逆平行βシートのように水素結合を作 る。残りのトリペプチドの主鎖は、4個の水分子と水素結合を形成する。Pro2のア ミドの窒素原子のみが蛋白質と本素結合を作らず、Tyr120の芳香環とGln51の側鎖 の中間にある。
y-CyPAは、現在のところペプチドとの複合体の結晶は得られない。サイクロスポ リンA(CsA)の複合体の結晶は、5Åの分解能で得られ解析した。これらは5量体を 形成する。y-CyPA単独の結晶には2分子存在し、Arg53のグアニディン基の向きが 異なる。e-CyPAのGln51とGln97に対応してy-CyPAのGln61とGln109は、同じ配 向をして水素結合し、99から101の残基の主鎖が平行に走り、ペプチドのプロリン のN米側が占める溝を作る。
h-CyPAとテトラペプチド(acetyl-Ala-Ala-cis-Pro-Ala-amidomethylcoumarin)の複 合体の構造解析の結果1g1は、e-cyPAと同様、Arg55, G1n63, Gln111の側鎖は、水素 結合のネットワークをつくり、101から103の残基の主鎖が平行に走り、テトラト リペプチドのプロリンのN米側がこの溝を占める。Asn102の主鎖がテトラペプチ ドのAla2の主鎖と逆平行βシートのように水素結合を作る。これらのアミノ酸残基 は、すべて酵母菌においても保存されている。
e-CyPAと結合するトリペプチドのΦ/ψの2面体角は、Ala1,Pro2,Ala3に対し てそれぞれ-119/146゚,-69/143゚,-67/146゚,である。トリペプチドのC末の p-nitoani1ideは、Phe48と隣接する分子のPro67と相互作用する。h-CyPAでは、テト ラペプチドのcoumarinが、Phe58と隣接する分子のTrp121と相互作用する。この分 子間の相互作用が、h-CyPAと結合するテトラペプチドとは、プロリンのC米側の2 面体角の違いを生み、Pro3とA1a4のΦ/ψの2面体角は、それぞれ -72/-179゚,-123/71゚である。
e-CyPAと結合するトリペプチドのAla-Proアミド結合のω角度は、-1.2゚で、ツイス トフォームの90゚から大きくずれている。
6. 考察
6.1 トランス異性体はCyPAのトリペプチド結合サイトによって認識されない
牛リボヌクレアーゼA、炭酸脱水素酵素II、コラーゲンタイプIII、リボヌクレアー ゼT1が変性剤でフォールトを解かれた後、これらの変性剤を薄めるとこれらの蛋白 質は自然に元に戻るが、リフォールドの過程でCyPを加えるとゆっくり進む段階が 加速されることが報告された。これらの蛋白質のシスープロリンのψの2面体角は、 e-CyPAと結合するトリペプチドのそれψ=143゚とほぼ同じ角度を持つ。他方、多く のシスープロリンを持つ蛋白質(サーモライシン、サブチリシン、エリスロキュロ リン、ブドウ球菌のヌクレアーゼ等)では、シスープロリンのカルボニル基COが、 逆方向を向きCyPによって加速されない。このような逆の配向は、CyPへ近づく側 (プロリン環側)に水が安定に付いてCyP結合サイトに近付けないからである。 シスートランス異性化反応のアッセイで、LiClを含むトリプルオロエタノール溶 液に溶かしたSuc-Ala-Ala-(cis-Pro)-Phe-PNAのミカエル定数Kmは、h-CyPAに対して O.87mMである。同じアッセイで、DMSOに溶かした基質であるプロリンを含むペプ チドはSuc-Ala-Ala-(cis-Pro)-Phe-pNAの測定に対して、活性サイトに競合して働きそ のKdは、20mM以上と見積られた。これらのペプチドは、また基質でありそのKmは Kdと同じである。シスとトランスの異性体の混合物の比がO.1であるので、シスープ ロリンのペプチドのKmは、2mM以下であり、一方トランス異性体のKmは、20mM 以下でないことを示す。更に、Suc-Ala-Leu-(cis-Pro)-Phe-pNAのシスートランス異性 化反応アッセイにおいて同じくPPIase活性を示すFKBPに対するミカエル定数 Km=0.5mMに対し、Suc-Ala-Leu-Pro-phe(cis/trans=1/9)が競合した時のKdは、 3mMである。このペプチドのKmは、Kdと同じある。従って、トランスー異性体の Kmは、ほぼ30mMであることを示す。これらのことは、CyPAもFKBPもトランスか らシスヘの異性化反応には働かないことを暗示する。すなわちシスから僅かに歪ん だフォームかトランスから大きくずれたフォームをこの疎水性のポケットが認識す ることを示す。更に言えば、CyPAの疎水性のポケットを形成する5個のアミノ酸残 基は、歪んだシスとツイストフォームしかこのポケットに誘導しない。
6.2 リガンドの結合機構
トリペプチド(Ala-Pro-Ala)は、プロリンがシス型を取った場合、水との相互作用 を考慮すると両側がAlaのみで短いとこれらが歪んだコンフォメーションを取っても エネルギー的に大きな損にならず、このV字型の特別なコンフォメーションは CyPAのペプチド結合サイトにフィットする。Suc-Ala-Leu-cls-Pro-Phe-pNAあるいは それより長いペプチド鎖では、全体で少しつつ歪んで緩和し、プロリンのシス型は ツイスト方向にある。従って、自らもツイスト型のシスからトランスヘ異性化する が、CyPによってその周囲の水が除かれより安定なトランスヘ加速され、立体障害 で離れていく。CyPに結合するシス型をとるとプロリンの先のアミノ酸がCyPとぶ つかり離れる。CsAにおいては環を作ることによりシス型が溶液で存在できるが、 CyPに認識されて疎水性の環境に来ると周囲の水が除かれより安定なトランスヘ異 性化し大きなコンフォメーション変化を伴う。ペプチドのプロリンが、e-CyPAと結 合するトリペプチドのシスープロリンの2面体角ψ=143゚を取った時アルギニンの 側鎖(Arg43(e-CyPA);Arg53(y-CyPA))と水素結合を作りペプチド結合サイトに付くこ とが出来る。しかし、ψ=143゚の配向は、長いペプチドあるいは蛋白質のループで は不安定でほとんど取らない。この配向も等しい割合でとれるトリペプチドは、こ のC=OとArg43の側鎖と水素結合をつくり安定化してくっついたと思われる。
HIV-1のGagのカプシド蛋白質は、CyPAにPro222で付くが、CyPBには付かない。 他方、HIV-2のそれはCyPAに付かずCyPBに付く。更に、CyPBは、simian immunodeficiency virus(SIV)であるSIVMAC239'SIVAGMSab384に付く。CyPAとCyPBのペプチド結合サイトはほぼ保存されているが、ペプチド結合サイトの近傍で細胞質型CyPAの異種間と膜結合型CyPBの異種間では、それぞれに共通であるがCyPAとCyPB間では異なる領域がL2のループのターンに見られる。このループのN米側は、 ペプチドのN米側の主鎖と水素結合作る。細胞質型y-CyPAとh-CyPAでは NAGPNTNGSであり、膜結合型のy-CyPBとh-CyPBではNA/RGKDTNGSで、CyPAは 固定型プロリンーアスパラギンに対しCyPBはイオン性残基のリジンーアスパラギン 酸である。大腸菌では1残基の挿入があるが、e-CyPAでは、RTQAPHSATAであり 一方、eCyPBではRTADKDSATSで前者は固定型プロリンーヒスチジン、後者は、イ オン型リジンーアスパラギン酸である。この僅かな違いが、Gagのカプシド蛋白質 の僅かな違いを区別し、更には、細胞質型CyPAと膜結合型CyPBに付くリガンドを 区別すると思われる。今後、膜結合型e-CyPB,y-CyPBについてリガンド結合部位の 詳細な構造を調べ、CyPAとCyPBのペプチド結合機構におけ僅かな差違を検証する ことにより、生理学的機能上の違いを解明することが可能と考える。
参考文献
[1] N. .J. Colley, E: K. Baker, M. A. Stamnes, C. S. Zuker, Cell, 67, 255-263 (1991).
[2] J. Luban, K. L .Bossolt, E. K. Franke, G.V. Kalpana, S.P.Goff, Cell, 73,
1067-1078 (1993).
[3] E. K. Franke, H. E. H. Yuan, J. Luban, Nature, 372, 359-362 (1994).
[4] M.Thali, et al., Nature, 3 72, 363-365 (1994).
[5] M. Konno, M. Ito, T. Hayano, N. Takahashi, J. Mol. Biol. 256, 897-908 (1996).
[6] H. Ke, J. Mol. Biol. 2 28, 539-550 (1992).
[7] V. Mikol, J. Kallen, G. Pflugl, M. D. Walkinshaw, J. Mol. Biol. 234, 1119-1130, (1993).
[8] P. J. Kraulis, J. Appl. Crysttalog., 24, 946-950 (1991).
[9] J. Kallen, M. D. Walkinshaw, FEBS Letters, 300, 286-290 (1992).