はじめに
精子は、雄の遺伝形質を卵に伝え、卵の発生を開始させるために必要な運動能と受 精能の二つの機能を備えた細胞である。しかし、精巣で形成されたばかりの哺乳動 物の精子は、この段階では、非生理的な処理を施さない限りその二つの機能を発揮、 することは出来ない。精巣精子は、精巣網を経て精巣上体に運ばれ、その細管の中 を通過するにつれて、前進運動をし、受精する能力を次第に獲得していくのである。 この様にして精子が一人前の機能を備えていく過程を「精子の成熟」と呼んでいる。
ところで、哺乳動物の精巣上体は、長さが数十メートルにも及ぶ一本の細管からで きており、精巣に近い部分から頭部、体部、尾部に分けられている。精子はその中 を数日から10日程かかって移動していくわけであるが、細管を頭部で縛って数日 間おき、そこに溜まってくる精子を調べても、前進運動も受精能も認められない。 精子が成熟するのには、単に一定時間を精巣上体細管の中で過ごせばよいというも のではないようである。それでは、数十メートルもの長い細管を辿る間に、精子は, どのように変化していくのであろうか。筆者が得た最近の知見を中心に概説する。
精巣上体の構造と機能
精子は精巣上体で初めて生理的条件下で前進運動をし、受精する潜在的な能力を獲 得する。ここで潜在的というのは、精子が精巣上体の中では運動性を示さず、適当 な緩衝液に希釈されてはじめて前進運動を開始すること、また受精する為には、受 精能獲得(capacitation)と呼ばれる変化をさらに受ける必要があることによる。その意 味で言えば、精巣精子でも、TritonX-100で除膜してATPを加えてやると鞭毛運動が 観察できるし、また丸い精細胞(round spermatid)顕微受精によって正常な産子を得' ることも可能であり(1)、運動と受精に必要な基本的な要素は精子形成が終わった 段階で既に備わっていると考えられる。しかし、精巣上体で精子が成熟すると、こ の様な非生理的な条件下でしか起こらなかった運動と受精が、生理的な環境の下で 起きるようになるのである。精巣上体の精子が自ら新たなタンパク質などを合成し ているとは考えにくいので、外部からのなんらかの働き掛けによって運動と受精の 2つの機能を担う機構が質的に変化することが、精子成熟の本質であるといえよう。
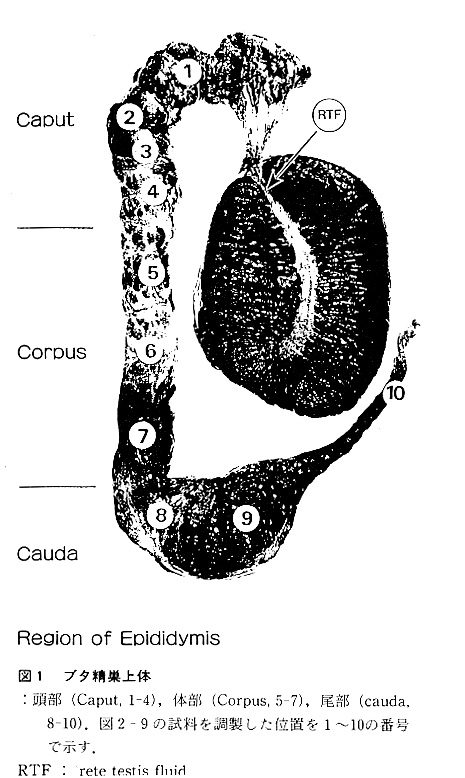
では、精巣上体とはどんな組織が、筆者が実験材料としているブタを例に概観して みよう。精巣上体は精巣網から発する数本の精巣輸出管が一つに合わさった細管か らなっており、その長さは50〜60mにも及ぶ。解剖学的には、頭部、体部、尾部 の3つの部分に区別されている(図1)。図2に精巣上体の各部位の上皮細胞の竜 子顕微鏡像を示すが、頭部の上皮細胞の分泌活性が非常に高いことが認められるほ か、細胞の長さも頭部から尾部へ移行するにしたがって次第に短くなっているのが 分かる。
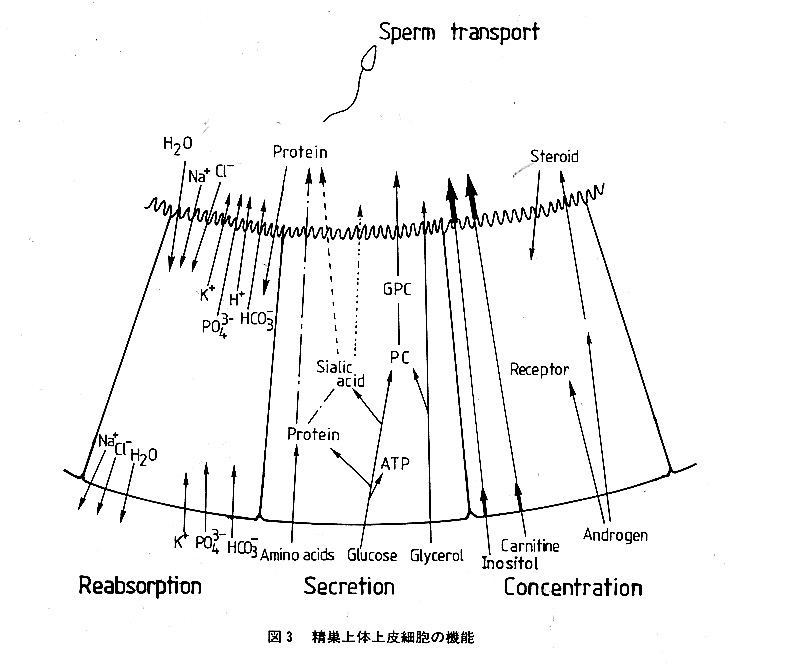
一方、精巣上体の生理機能は、図3に 示されるように、精子の運搬、イオン、 タンパク質などの、再吸収と分泌、及び カルニチンやイノシトールなど血中成分 の濃縮の4つに大別できる。これらの機 能によって、精巣上体を運ばれていく精 子の細胞外液が形成されているのである が、ある種のタンパク質の分泌など、精 巣上体のかなり限定された部位でのみ起 こるものもあり、精子外液の組成は精巣 上体の場所によってかなり異なっており 均一ではない。未熟精子は、頭部から尾 部へと移行していく間に、それらの影響 を順次受けて成熟精子へと変化する。


実際に、精子が成熟するためには精巣上体頭部から尾部までの長い道のりを辿る必 要があることを多くの研究グループが報告している(2〜4)。即ち、精巣精子を精 巣網や精巣上体頭部に数日間停留させても運動性は幾分発達するけれども受精能を 獲得するまでには至らないこと、又、精巣や精巣上体頭部の精子を精巣網漿液や精 巣上体尾部液中でインキュベートしたり、精巣精子を精巣上体尾部管腔内に注入し て数日間放置しても成熟を示唆するような運動性の変化は認められず、勿論受精能 の発達もないことが明らかにされている。いずれにしても、精巣上体の状態によっ て尾部へ到達した精子の運動性や受精能などの性状が影響される訳で、男性不妊症 のなかには精巣上体における精子の成熟不全を原因とするものもあると考えられる。
精巣上体分泌液による精子表層の修飾
1)成熟に伴う精子の活性変化
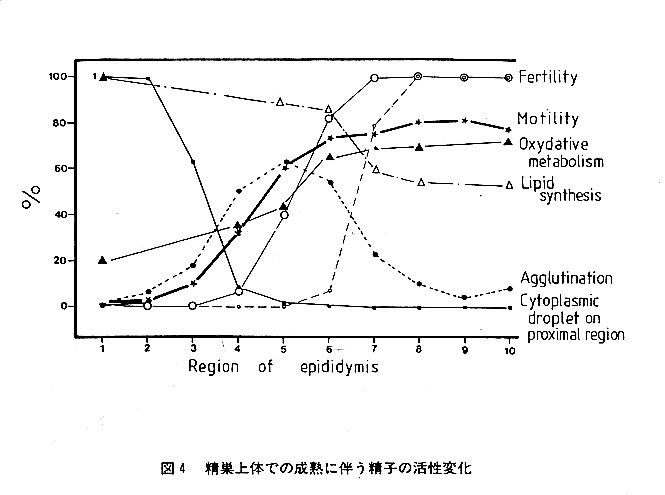
精巣上体を通過していく過程で精子にはどのような変化が起こっているのであろう か。図4にブタ精子の例を示す。運動能や受精能、代謝活性など、精巣上体頭部の 終りから体部を通過する時期に精子の活性に大きな変化が起きていることが分かる。 これは、精巣上体頭部から体部にかけての上皮細胞の分泌、吸収活性が高いことと 関係があろう。この部位の分泌液中に精子表層に結合したり、精子内に取り込まれ ることによって、精子にこれらの変化を生じさせるシグナルとなるような特定の物 質が存在すると考えられる。
2) 精巣上体分泌タンパク質
精巣で形成された未熟精子は、精巣分泌液と共に精巣上体へ運ばれるが、精子を取 り巻く環境は精巣上体頭部で大きく変化する。Na+,C1-イオンや水は吸収されて精子 。濃度は精巣分泌液中の約108cell/mlから5〜8×10gcell/mlへと上昇する。又、精巣分 泌液由来のタンパク質のほとんどは頭部の上皮細胞によって吸収されてしまい、上 皮細胞から分泌されたタンパク質がこれに取って代わる(5)。
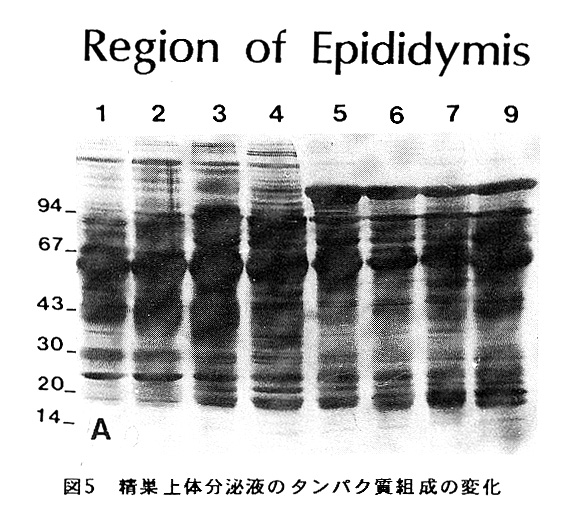
図5に精巣上体各部位の分泌液中の タンパク質のSDS-PAGE上での泳動パ ターンを示す。精子外液中のタンパ ク質の組成が精巣上体頭部から尾部 へ移行するのに従い大きく変化する ことが分かる。これらのタンパク質 の一部は、精子表層に結合し、精子 細胞膜の性質や機能を変化させると 考えられる。実際に、精子表層のレ クチン結合性や抗原性、脂質組成、 荷電状態、イオン透過性などが成熟 にしたがって変化することが報告さ れている。前述の様に、精子が成熟 するのに、精巣上体の頭部から尾部 まで移動していくことが必要であるならば、精巣上体の特定の部分で分泌されてい るタンパク質が精子成熟にとって特に重要ではないかと考え、現在そのようなタン パク質の同定を行っている。
我々は、ブタ精巣上体で部位特異的に発現している135、70、65、40、23、20、 19kDaの7種類のタンパク質に着目し、それらを精製する一方、cDNAの塩基配列を 決定した。図6は、精巣と精巣上体の各部位から調製したRNAに対してノーザンブロッ ト法によって、これらのタンパク質のmRNAの発現部位を調べた結果をまとめたもの である。精巣上体頭部前半では、65と23kDaタンパク質の合成が認められる。65kDa タンパク質はN-アセチル-β-グルコサミニダーゼと同定され、精巣上体内での精子の 凝集を阻害していることが分かった。又、23kDaタンパク質は精巣上体特異的なグル タチオンペルオキシダーゼ様タンパク質と同定されているが、これに関しては後ば と触れる。
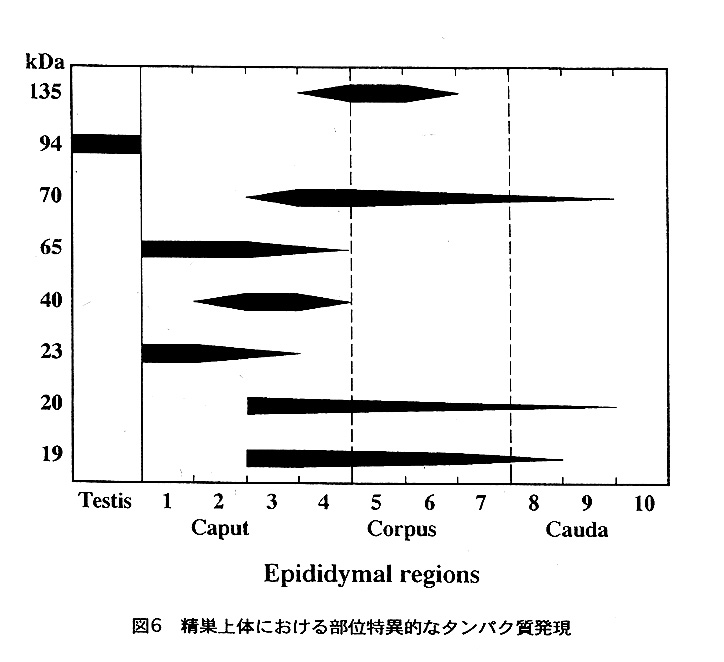
40kDaタンパク質はプロカテプシンLであることが分かったが、精巣上体の中では 頭部後半のみで発現が認められる。プロカテプシンLは通常はプロセッシングを受け て、lysosomeで働く酵素であるが、精巣上体では、プロ体のまま分泌されている。精 巣上体の中での生理作用はまだ分かっていないが、最近プロカテプシンLが、プロ体 のままでもタンパク質分解活性があることが報告されており、成熟過程の精子表層 の修飾に一役買っていることも考えられる。
精巣上体頭部後半からは、さらに、70kDaと19kDaタンパク質が分泌されているが、 これらは、体部から尾部にかけても僅かながら合成されている。70kDaタンパク質は、 ミルクタンパク質の一つであるラクトフェリンと同定された。ラクトフェリンは、 これまで精嚢から分泌されて、射出精子の主要被服タンパク質として抗菌的に働い ているとされてきたが、精巣上体で、既に分泌され成熟過程の精子に結合している ことが明らかになったことから、未知の生理機能をはたしている可能性もある。 19kDaタンパク質は、ペプチド部分が15kDaの糖タンパク質で、精巣上体でのみ発現 している組織特異性の非常に高いものであるが、まだその生理活性は同定されてい ない。
頭部の終りから体部の前半でのみ合成されている135kDaタンパク質は、これまで 報告のない、精巣上体に特異的なα-mannosidaseであることが分かった(6)。精子 の受精能との関連が示唆される知見が得られているので、これについても後ほど述 べることにする。さらに体部から尾部にかけて合成されている20kDaタンパク質は、 Brooks等によって報告されたretinoic acid binding proteinと同一のものであった(7)。
さて、精巣上体全体としては、その機能はアンドロゲンによって調節されているわ けであるが、それだけではこれらの部位特異的なタンパク質発現の説明はできない。 前述のプロカテプシンLを例にとると、プロカテプシンLは、癌細胞でプロ体のまま 分泌されているほか、ある種の正常培養細胞で、TPAやPDGF処理によっても lysosomeへ運ばれる代わりにプロ体のまま細胞外に分泌されることが知られている。 精巣上体におけるPDGFの分布を調べたところ、プロカテプシンLが分泌される精巣 上体頭部後半のすぐ上流でPDGFが合成分泌されていることが示された。さらに詳し い検討が必要であるが、特定の部分で分泌されたものがその下流に運ばれて、そこ で別のタンパク質の合成を調節するという精巣上体の機能分化のメカニズムの一つ を示唆する結果であろう(8)。
3) 135kDa protein
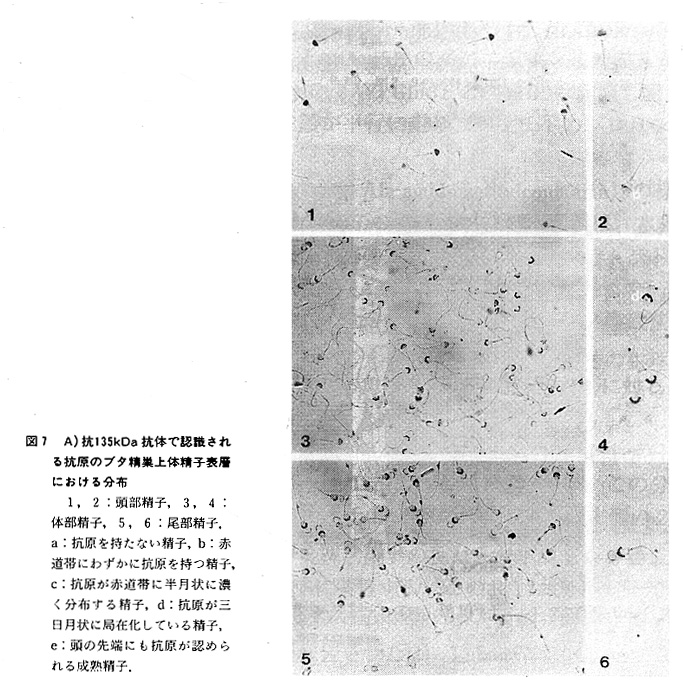
次に、部位特異的に分泌されたタンパク 質が、成熟過程の精子に直接作用してい る例を示す。精巣上体頭部の終りから体部 前半でのみ合成されている135kDaタンパク 質は、その構造と酵素学的な解析から、こ れまで報告のない新しいα-mamosidaseと同 定された。図7は、抗135kDa抗体により精 子表層上の抗原の分布を見たものである。 精巣上体頭部の未熟精子にはほとんど抗原. が見られないが、体部に移行するにつれて、 赤道帯に僅かに検出できるようになる。さらに下降するに従い、次第にその量が増 し、体部後半では先体のすぐ後ろの部分に三日月状に局在化、濃縮されることが分 かった。尾部の成熟精子の抗原はほとんどが同様の局在バターンを示し、さらに頭 の先端部にも抗原が移動してくることが判明した(9)。これらの結果は精巣上体か ら分泌された135kDaタンパク質が未熟精子の赤道帯に結合し、成熟にともなって、 次第に先体後端の表層に局在化されることを示している。ブタ精子はこの部分を介 して卵膜に結合することが知られているのみならず、精子と卵との相互作用には、 高マンノース糖鎖を初めとする糖鎖が重要な役割を果していることが示されており、 このタンパク質と精子の受精能との関連が示唆される。一方、このタンパク質の精や 子上での分布竺態によって精子の成熟度が判別できるわけで、良好な受叩を持つ 精子の選別などに精子の成熟度を示す分子マーカーとして利用できると考えられる。
4) 23kDa protein
さて、精巣上体は精子の成熟を助ける一方で、精子を酸化的傷害などから保護する 作用も持つと考えられている。実際、哺乳動物の精子には非常に多くの多価不飽和も 脂肪酸が存在し、容易に活性酸素種のアタックを受けて過酸化脂質を生じる。精子 において酸化的傷害を起こす主因は過酸化脂質であるとされ、この増加によって受、 精能が低下することが報告されている。精巣上体頭部前半から分泌されている23kDa proteinは、ほとんどの組織の細胞質で通常発現している活性酸素消去酵素であるグ ルタチオンペルオキシダーゼ(GPX)のホモログであることが判明した。精巣上体にお いて、過酸化脂質の増大に対する防御機構の役割を23kDa proteinが果しているのでへ はないかという推測が可能となるが、細胞質型のGPXが活性中心にセレノシステイ、 ンを持っているのに対して、23kDa proteinではセレノシステインがシステインに置、 き換わっている。そこで23kDa proteinのGPXとしての活性を測定したところ、細胞 質型のものと比較して、基質との親和性は1/1000,最大反応速度は1/150と極めて低 いものであった。セレノシステインがシステインに置き換わったことによるものと 考えられるが、活性中心付近の立体構造がどのように変化しているか興味深い。さ らに、精巣上体分泌液中のGPXのもう一方の基質であるグルタチオンの濃度も、至 適濃度よりはるかに小さく(1/200)、23kDa proteinが、GPX活性によって過酸化 水素や過酸化脂質による酸化的傷害から精子を保護するという機能を果していると は考えにくいことが明らかになった(10)。
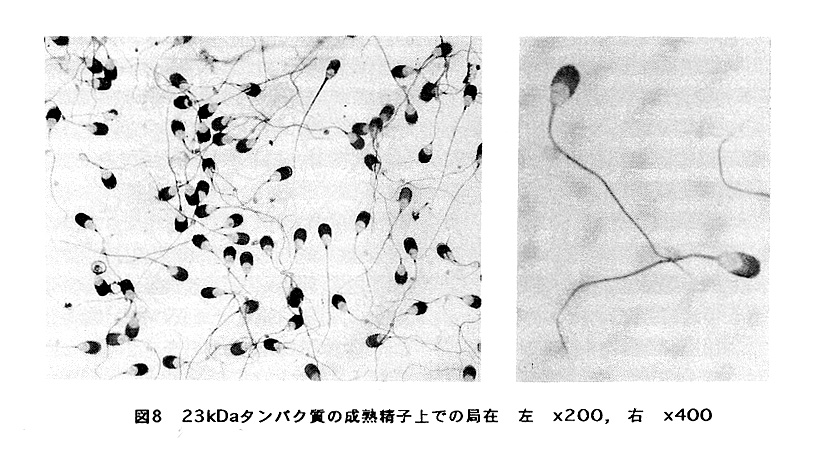
それではこのタンパク質は何をしているかということであるが、分泌された後に成 熟過程の精子の先体部分の表層に結合することが分かった(図8)。又、先体反応に ともなって、このタンパク質は、先体表層から消失するため、抗23kDa protein抗体 を用いて、先体反応を起こした精子と起こしていないものを分別することが可能と なる。更に、このタンパク質で精子を処理することによって、先体反応が50%程度 まで抑えられることも判明した。これらの結果は、二のタンパク質か、酵素活性は 持たないものの、精子の先体表層に結合することによって、精巣上体内での早すぎ る先体反応を抑えて、精子の受精能を維持していることを示している。
精巣上体上皮細胞との共存培養による精子成熟系の確立の試み
じこれまでは、精巣上体の様々な部位から分離された精巣上体分泌液や成熟途上にあ る精子について、そのタンパク質組成の変化や、分泌液成分による精子の活性調節 などを解析することによって、精子成熟の解析が試みられてきた。精子と精巣上体 との相互作用をより直接的に解析するためには、精子と様々な部位の精巣上体管上 皮細胞の共存培養系があることが望ましい。しかし、精巣上体管上皮細胞の培養は、 未成熟なラットやハムスターでは報告はあるものの、成熟した家畜では全く無い。 これは、分離された上皮細胞がコラーゲンなどでコートした培養容器に接着するの を、混在する大量の精子が妨げるためである。
筆者等は、先ずmicro perfusionにより、精巣上体管内の精子をできるだけ洗い出し、 更に、上体管をコラーゲテーゼで満たした後、両端を閉じて37℃で短時間保温する ことによって上皮細胞を遊離させた。洗浄後、コラーゲンでコートしたプラスチッ クシャーレとミリポアフィルター(ミリセル)に付着させて培養した。培養3日目には 上図9に示すようなコロニーが形成される。培養上皮細胞の分泌活性が保持されている か、前述の精巣上体体部分泌液中に見い出される135kDaタンパク質の分泌活性で調 べた。プラスチックシャーレで培養した場合には、分泌活性は速やかに消失するが、 ミリセル上で培養した場合には、精巣上体頭部後半から分離した上皮細胞で、培養1 週間後も保持されていることが分かった。
上皮細胞との共存培養によって精子を成熟させるためには、精巣上体の各部位で特 異的な機能が保たれていなければならない。更に培養条件を改良する必要があると 思われる。さて、その可能性であるが、in vitroで精子を成熟させる試みは、 Orgebin-Cristのグループが、ウサギ精巣上体管り器官培養の系で、またのMooreグルー プが、ハムスターの精巣上体管上皮細胞との共存培養の系で報告している(11〜13)。 Moore等は、精子の運動性と受精能の増大を観察しており、in vitroで精子を成熟さ せることは充分に可能であると考えられる。いずれにしても、この様な試みは始め られたばかりであり、今後家畜などの大動物や人へと発展していくものと思われる。
おわりに
畜産や不妊症治療における体外受精の新しい技術の開発には目を見張るものがある。 精子や受精卵の凍結保存法、更に顕微受精法など、配偶子を取り扱う方法の急速な 進展を考えると、人工受精もいかにして受精率を高めるかから、いかにして正常で 優れた配偶子を選択するかが問題とされる時期になったといえる、精子の運動性が いかにして備わり、調節されるか、又、同種の卵を認識して受精するための分子基 盤がどのようにして精子に付与されるかなど、精子成熟の分子機構が早急に解明さ れねばならない。しかしながら、現状は、個々の現象についての基礎的知識が蓄え られている段階で、精子の運動能や受精能の発現を統一的に説明するには程遠い。 この分野の研究者の数が圧倒的に少ないのもさることながら、新しいアプローチが 必要である。その意味で、最近始められたばかりでまだほとんど実績はないが、精 巣上体上皮細胞との共存培養による精子成熟の試みの一端を最後に紹介した。この 様な培養系が確立されれば、精子成熟の本質の解明ばかりでなく、なんらかの原因 で精巣上体の機能が損なわれた場合に、精巣精子を成熟させて受精させるという臨 床への応用も可能となろう。
文献