
第二回は筆者が行っている低温実験の手順(中追雅由、1995;Nakasakg,1995)に ついて簡単にまとめたいと思います。現在、筆者が、実験室や放射光実験施設で 行っている低温実験では、1)抗凍結剤の導入 2)結晶マウント 3)冷却 4) データ収集 5)結晶保存の順番で作業を進めており、以下では、この順番に要 点をまとめさせて頂きます。
1. 抗凍結剤の導入
水を含む生体試料全体を非常に高い冷却速度で急速冷却できれば、試料に含まれ る水はガラス状に凍結されます(Mayer&Brueggener,1982)。実際、電子顕微鏡 による生体高分子の観察では、液体エタンを用いた急速冷却によりガラス状の氷に 包埋された試料が作成できます(豊島、1990)。
電子顕微鏡観察での対象となる試料(3次元超微結晶、二次元結晶、チューブ状 結晶)と、我々がX線回折実験で使用する試料(結晶)の大きな違いは、試料物体 のサイズであります。これは、電子とX線光子の物質との相互作用における散乱 断面積の違いに起因しています(Heit1er,1953)。結晶は電子顕微鏡での試料の千 倍程度の容積をもつため、電子顕微鏡で行われる冷却作業を結晶に連用することは できません。通常使用される蛋白質結晶試料の大きさから予想して、その液体窒 素温度への冷却時間は、液体エタンを用いた場合でも数十ミリ秒以上を要すると考 えられます(表1)。蛋白質結晶をこのような速度で冷却しても、結晶に含まれ る水の表層部分以外は六方晶の氷として析出し、結晶を破壊します。
氷の生成を回避する最善の策は、水が有しているガラス転移を起こす性質を促進 する抗凍結剤の使用であります。抗凍結剤として使用さ軋る薬品として、表2に 掲げたものがあります。ロバーズとスレイタの著書(Robards&S1eytr,1985)にも 示されているように、これらの薬品を水に添加すると、水のガラス転移温度や、ガ ラス状態から氷に転移する温度が上昇します。抗凍結剤のこの性質を利用して、 冷却が遅い蛋白質結晶でも、氷の生成を抑制することが可能です。


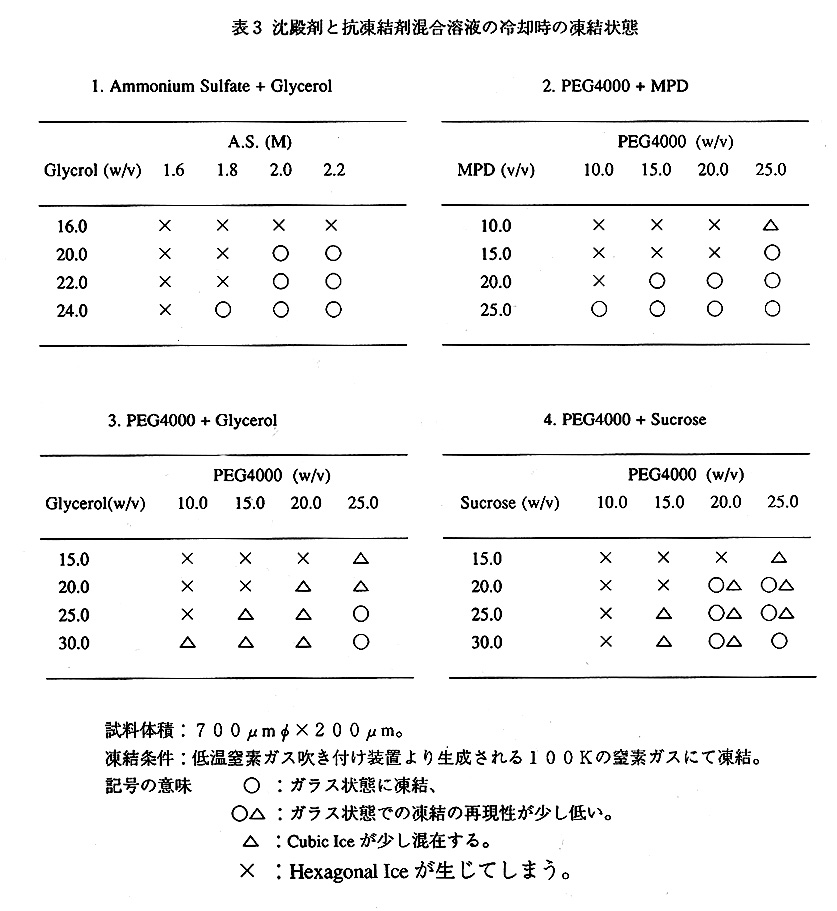
蛋白質結晶は、ある濃度以上の沈殿剤溶液で安定なため、沈殿剤溶液に抗凍結剤 を添加して、結晶内の母液を抗凍結剤入の沈殿剤溶液に置換する方法が採用されま す。抗凍結剤入の沈殿剤溶液への置換際しての留意点は、とにかく、結晶に浸透 圧ショックなどを与えないことです。筆者の場合、通常、ミクロセルを用いた透 析法によって抗凍結剤の導入を図っています。透析外液の沈殿剤および抗凍結剤濃 度はあらかじめ予備実験にて決定しておきます。この予備実験は、実際の蛋白質 結晶冷却とほぼ同じ条件下で行われます。表3には、結晶化で使用頻度の高いポ リエチレングリコール4000、硫酸アンモニウムに抗凍結剤を導入するための混 合条件検討結果を掲げてあります。
低温実験に使用される抗凍結剤は、 すべてが万能というわけではなく、 その時々によって検討が必要であり ます。たとえば、硫酸アンモニウ ムで析出した斜方晶系トリプシィ結 晶は、グリセロール存在下で溶解し てしまい、ショ糖を使用しました (中追雅由、1995)。また、 相分離が生じるため、硫酸アンモニ ウムには、メチルペンタンジオール、 ポリエチレングリコールなどを添加 できません。
最近は、結晶化条件のデータベー スが存在しますが、同様に低温実験 においても、凍結条件の探索が容易 なように、結晶母液の組成、抗凍結 剤溶液の組成、冷却速度(冷却時間) 二、冷却方法についてのデータベース があると、頗る有効ではないでしょ うか。
2. 結晶のマウント
動物の毛や毛髪もループ部分の素材として道しているようです。筆者の場合に は、今のところ、金魚すくい部分をキャピラリーから切り出したリングで作成する マウント具を使っています(Nakasako,1995)。これを使い始めたのは、ループ部 分のX線吸収、X線散乱(回折)が低減されると考えたからであります。それぞ れ、長所短所を持ち合わせており今後も色々な低温実験用結晶マウント具が開発さ れることが望ましいと思います。これらのマウント具は、ブラスピンに接着し、 ブラスピンには、強力な希土類磁石を接着しておくと操作性が向上する(図1)。
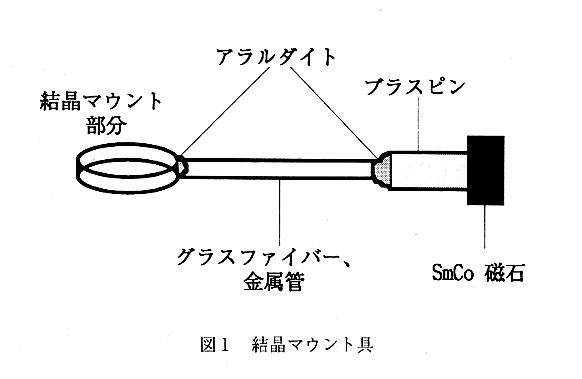
結晶をこれらのマウント具ですくいとる際には、結晶を一度デプレッショングラ ススライドなどの底の浅い溶液に移してから作業をすると簡便であります。また、 これらのマウント具は、結晶を移動させる(たとえば重原子溶液へのソーキング) 場合に、簡便な操作を提供します。
3. 冷却用寒剤
結晶の急速冷却には、冷却効率の高い、低温窒素ガス、液体エタンや液体プロパ ン(Hartmam,1982)を使用します。通常、寒剤として良く使用されている液体窒 案を用いないのは、液体窒素に温熱物体を挿入したときに生じる発泡が、界面での 熱伝達を著しく妨げるためであります。表1には、液体窒素と液体エタンの冷却 速度を比較してあります。液体窒素の場合には、発泡現象のために冷却に遅延が 生じ、熱電対のサイズを変えても、冷却時間に変化はありませんでした。
安全性の面から考えると、低温窒素ガスが扱いやすいのですが、冷却効率では、 液体エタンや液体プロパンの使用が絶対有利であります。液体エタンや液体プロ パンを安全かつ簡便に扱うための装置が、ライヒェルト社から、電子顕微鏡試料作 成用に市販さ札ています(Robards & S1aytr, 1985)。
低温窒素ガスでの冷却の場合、蛋白質結晶を単にガス流上に設置して、低温ガス ー気に吹き付ける作業を行うだけで、冷却速度は一定であります。一方で、液化 ガスの場合には、液体への試料投入速度を変化させることで、冷却速度を変化させ ることが可能であります(Robards & Crosby, 1983)。
4. 冷却
1)、2)、3)の用意と準備が整ったらいよいよ冷却を行うわけですが、実験 機器も含めてこの際の注意として以下のことが揚げられます。
低温窒素ガスを用いた冷却は、
という手順で行われます。抗凍結剤の検討が良くなされており、結晶マウント呉 1の設置を的確に行えば、冷却に失敗することはまずない。冷却に失敗した場合に は、結晶および溶媒が白濁する。100Kにて得られたトリプシン斜方晶系結晶 からの回折パターンを図3に掲げます。
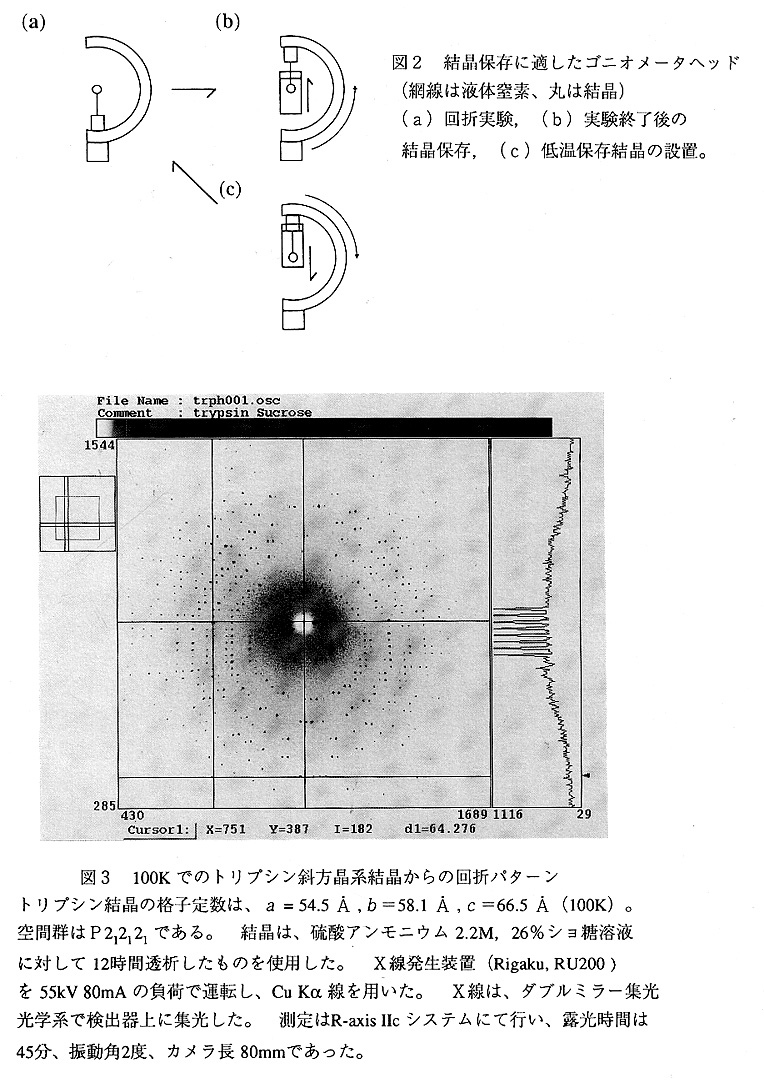
5. 結晶の保存
結晶を破壊することなく冷却するが可能であば、結晶を液体窒素中で保存するこ ともできます。このために必要な器具としては、特殊な形状のゴニオメータヘッ ド、細胞凍結保存用容器、ケーン、チューブ形状容器(ハンプトンリサーチ社のク リスタルキャップシステム参照)などです。結晶保存での問題は、一度冷却した 結晶を如何にして結露することなく移動させるかです。その点で、図2に示した 様なゴニオメータヘッドはぜひとも必要なアクセサリーであります。液体ガスで 冷却する場合には、周りに液体窒素から蒸発した低温窒素ガスが存在しますので、 冷却された結晶部分を液体ガスから取り出した後も、低温窒素ガスの存在領域で作 業を行えば問題はありません。
結晶の液体窒素中での保存は、次のような福音をもたらしてくれます。
6. おわりに
低温実験の手順構築を行う上で東京大学分子細胞生物学研究所の豊島近教授、(株) ディスコ精密ダイヤ事業部の梅田桂男氏に御助言、御助力を頂きました。松下電 器産業(株)国際研究所の前田雄一郎博士と藤吉義則博士には、液体ガスによる結 晶冷却方法の御助言を頂きました。低温実験を行う上では、理化学研究所放射光 構造生物学研究推進グループより多大なる御援助頂き、また、文部省重点領域研究" 蛋白質立体構造の構築原理"よりも御援助を頂きました。深く感謝申し上げます。
参考文献