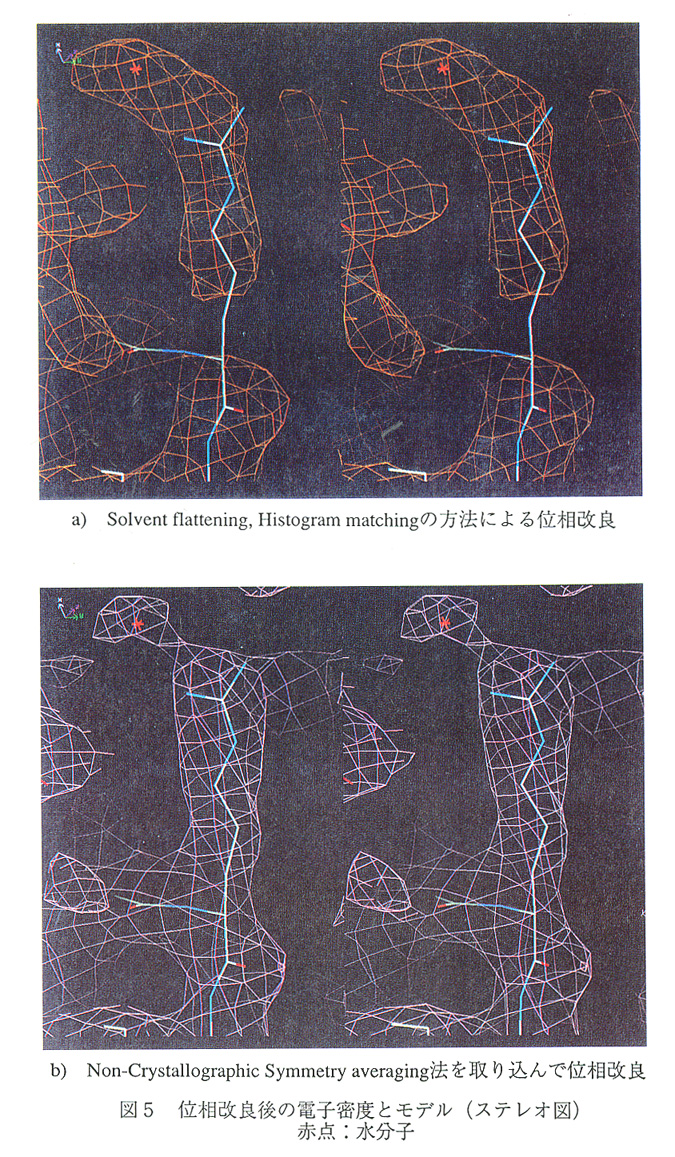
チトクロム酸化酵素の構造解析に用いた位相改良の手法は、Solvent flattening,Histogram matching,Non-Crystanographic Symmetry averagingである。これらの位相改良法により電子 密度が如何にきれいになっていったかを述べる。
構造解析に用いた結晶は、斜方晶系で、空間群がP212121 、格子定数がa=189.1Å, b=210.5Å,c=178.6Åであった。非対称単位中には2分子存在し、チトクロム酸化酵素1 分子の分子量が20万であることから、結晶中での溶媒の占める割合は約70%であった。
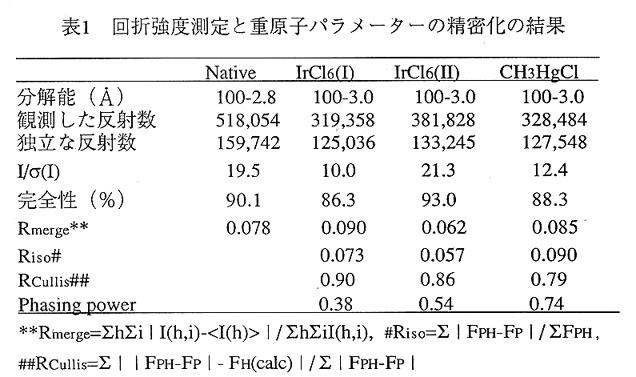
この斜方晶系結晶が出てから約2年という早さで構造解析できた要因には 1)すばらしい結晶が出たこと 2)良質の回折強度デ-タが集められ、重原子による僅かな回折強度変化が 観測できたこと(表1、図1) 3)位相改良により明瞭な電子密度が得られたこと これら3つのことが考えられる。特に、MIRだけからの電子密度では1分子の解釈でさえ 困難であったのが、位相改良により、明瞭な電子密度が得られ、1800残基を僅か1カ 月足らずで組み上げることができた。本稿では、3番目の要因である位相改良の効果につ いて述べるが、良い結晶と良質の回折強度データが得られば、位相改良が非常に効果的な 方法の一例としてチトクロム酸化酵素の構造解析における位相改良の結果を示す。位相改 良の流れと使用したプログラムについては図2に示している。

1. 初期電子密度
3種類の重原子誘導体結晶を使用して3Å分解能までの位相を得た。各重原子誘導体の メインサイトは差パターソンから容易に同定できた。マイナーサイトは差フーリエから求 めたが、差フーリエに用いた位相はSolvent flatteningとHistogram matchingの方法で位相改良 したものである。
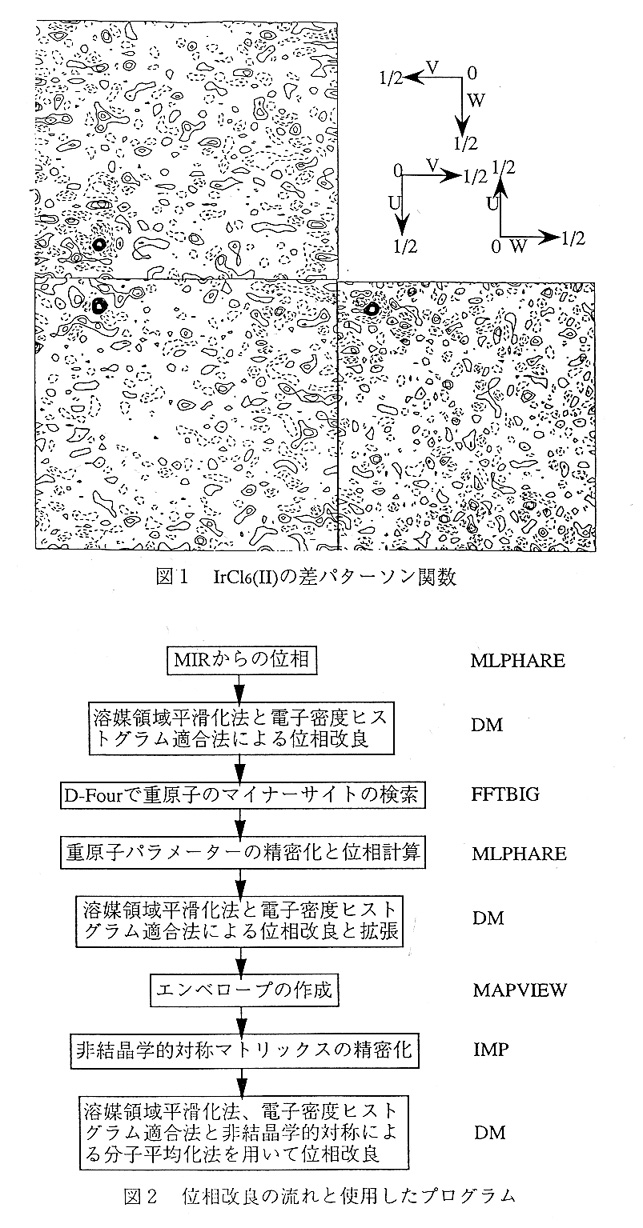
まず、水銀誘導体結晶(CH3HgCl)の差パターソンから8個の重原子位置が、イリジウ ム誘導体結晶(IrCl6(Ⅱ))の差パターソン(図1)からl個の重原子位置をそれぞれ決定 した。重原子パラメーターの精密化をMLPHAREで行った結果、Rcullis及びPhasing power は水銀誘導体(CH3HgCl)では0.86と0.57、イリジウム誘導体(IrCl6(Ⅱ))では0.89と0.43 であった。平均のfigure of meritは3Å分解能で0.22であった。この位相をSolvent flattenigと Histogram matchingの方法で溶媒領域70%の条件で30サイクル位相の改良を行った。改 良した位相を使ってそれぞれ重原子誘導体の差フーリエを計算したところ、ノイズが少な く、重原子ピークだけが顕著に現れ、マイナーサイトが見つけやすい差フーリエ図が得ら れた。それぞれの差フーリエ図から、水銀誘導体では新たに15個、位相計算には使っ ていなかったイリジウム誘導体(IrCl6(Ⅰ))では8個の重原子サイトが見つかった。これら の重原子パラメーターを精密化し、位相を求め、これを初期位相とした。Rcullis及び Phasing powerは水銀誘導体(CH3HgCl)では0.79と0.74、イリジウム誘導体(IrCl6(Ⅱ))で は0.86と0.54なり、平均のfigure of meritも3Å分解能で0.33とマイナーサイトを加えるこ とにより、位相は改善された。この初期位相を使って電子密度を描かせたところ(図3)、 2分子分の塊が確認できたが、C軸方向の分子境界と2分子間の境界を見つけることはで きなかった。
2. Solvent flatteningとHistogram matchingによる効果
DMを使用したSolvent flatteningとHistogram matchingの併用による位相の精密化は、溶媒 領域を70%とし、5Å分解能から初めて200サイクルの繰り返しによって2.8Å分 解能まで位相を拡張した。精密化の指標となるRFreeは0.53から0.28に下がった。得られた 2.8A分解能までの位相を使って電子密度を描かせたところ(図4)、溶媒領域のノイ ズがほとんどなくなり、12量体分子が見事に浮かび上がってきた。MIRからの電子密度で は判断できなかったC軸方向の分子境界や2量体間の境界を決めることができ、チトクロ ム酸化酵素1分子を切り出すことができた。ここでの位相改良では溶媒の占める割合が非 常に高いので、Solvent flatteningが非常に有効であったと考えられる。

3. Non‐Crysta11ographic Symmetry averagingによる効果
この結晶は非対称単位中に2分子あるので、Non-Clystanographic Symmetly averagingによ る位相の改良を行った。Non-Clystallographic Symmetly averagingを行うためには
1)適正な1分子領域のマスク
2)正確な非結晶学的対称マトリックスの決定
が必要である。
1)適正な1分子領域のマスクの作成
マスクの作成は、Solvent flatteningとHistogram matchingによって改良した電子密度を用 いて、PHASESのMAPVIEWを使って行った。MAPVIEWは1セクションごとの電子密度図 をマウス操作で囲むだけなので、短時間で的確なマスクが作れる。しかし、今回のパネル ディスカッションで鈴木先生ら(名大工)が使われていたMAKEMASKがMAPVIEWとほ とんど同じ機能を持ち、さらに、任意の方向から電子密度が見ることができるという点で 優れていると感じた。
2)正確な非結晶学的対称マトリックスの決定
NATIVE結晶のパターソンから、この結晶がB面心に近い並進対称を持っていることが 分かっていた。B面心に近い並進対称をあらわすマトリックスを非対称単位中に存在する 2分子間を関係づける非結晶学的対称マトリックスとした。この非結晶学的対称マトリッ クスは上述の方法で作成したマスクとSolvent flattening,Histogram matchingによって改良し た電子密度を用いて、RAVEのIMPを使用して精密化した。マトリックスを精密化した結 果、対称操作で関係づけられる2分子の電子密度の相関係数が0.27から0.59と上昇し、正 確なマトリックスが得られた。
そこで、Solvent flattening,Histogram matchingの方法で改良した位相をさらにNon- Crystallographic Symmetry averaging法も取り込んで、再び5Å分解能から2.8Å分解能ま で位相の改良を行ったところ、RFreeは0.26、非結晶学的対称の関係にある2分子の相関 係数は0.92と十分良い値となった。Non-Crystallographic Symmetry averaging法を取り込むこ とによって、Solvent flattening,Histogram matching法による位相改良では主鎖と側鎖が切れ ていたところが繋がったり、側鎖と水分子がはっきりと分離して、非常に解釈しやすい電 子密度(図5)が得られた。
以上の方法で得られたチトクロム酸化酵素の電子密度は非常に明瞭で、主鎖のカルボニ
ルの酸素のふくらみもはっきりと現れていた。チトクロム酸化酵素の構造解析においては
位相改良は非常に効果的であり、特に結晶中での溶媒領域が70%と高かったのでSolvent
flattening法が最も有効であったと考えられる。