1. はじめに
ウシの網膜から単離されたリカバリンは、ガルモデュリンに代表されるEFハンド型 Ca2+結合タンパク質の仲間である1)。しかし、膜結合タンパク質を制御するという生理活 性を発現するために、これまでに知られているEFハンド型タンパク質にはない構造上の 特徴を持っている。それはN末端が脂肪酸(主にミリストイル酸、図1参照)で修飾さ れている点で2)、リカバリンは、この疎水性部分を利用して細胞膜と相互作用し川、ロ ドプシンキナーゼの活性を調節していると考えられている。この膜との相互作用は Ca2+依存的に起こることから、カルシウム−ミリストイルスイッチの概念が提案されて いる3)。何故Ca2+非存在下では膜と結合しないか、そしてどのようにCa2+の結合と膜との 相互作用が連動しているかといった疑問が自然に浮かぶ。これらの疑問に答えるために は、Ca2+結合および非結合状態のリカバリンの三次元構造を解き明かす必要がある。こ れまでに、1個のCa2+を結合した、ミリストイル基を持たない変異型リカバリンの結晶 構造が報告されているが5)、この構造からはミリストイル基の挙動について何の知見も 得られない。ミリストイル基を有するリカバリンの結晶化が非常に困難であることから、我々は核磁気共鳴(NMR)法によって、カルシウムーミリストイルスイッチ機構の原子 レベルでの解明に取り組んだ6,7)。
2. 実験と方法
13Cおよび15Nでラベルされたタンパク質は、大腸菌によるリカバリン産生系を利用し て調製した。ミリストイル化は、N-myristoyl-CoA transfeaseを共発現することにより行っ ている。この酵素は、ミリストイル化のコンセンサスシークェンス(GXXXSX)をN末 端に持つタンパク質のグリシン残基に、ミリストイル酸を共有結合させる。この共発現 系と13Cでラベルされたミリストイル酸を含む培養液を利用すれば、後で述べるようなミ リストイル基だけが13Cでラベルされたタンパク質を調製することが可能である。
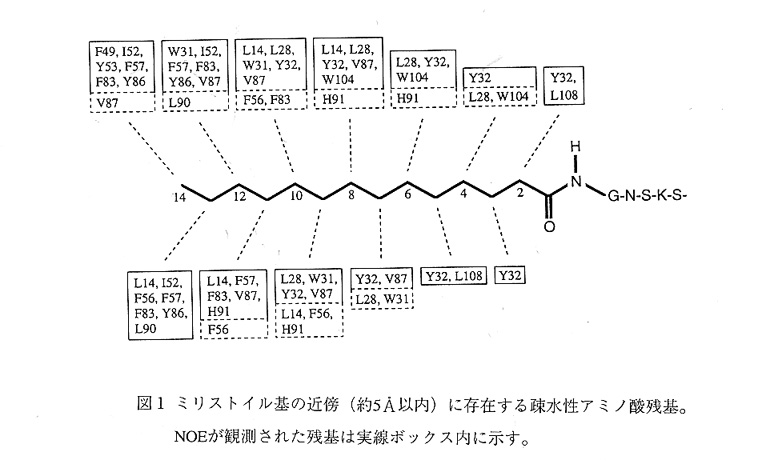
1H、13Cおよび15Nシグナルの帰属、N0E[空間的に近い(約5Å以内)1H-1H問にのみ 観測される]の帰属、そして構造計算といった多次元NMR法による構造決定に関しては、 一般的な方法として既に確立されているので、ここではその詳細を省く。ただ、リカバ リンの分子量は約23,000と大きく、この方法の限界に近いサイズであるということだけ 触れておく。また、問題のミリストイル基がタンパク質のどこに結合しているかを明ら かにするためには、一工夫必要であった。というのも、ミリストイル基のシグナルはア ミノ酸のシグナルと重複しており、観測されているNOEがミリストイル基とタンパク質 との間のものか、それともタンパク質内のものかの判断が非常に難しいからである。ミ リストイル基のみが13Cでラベルされたサンプルを特別に調製し、[13C/F1]-edited [13C/F3-fi1tered HMQC-NOESYという特殊なNMR測定を行った。この測定法は、13Cに結 合している1Hと12Cに結合している1Hの間のNOEだけを選択的に与える。したがってこの 場合、ミリストイル基とタンパク質の間にのみNOEが観測される筈である。測定の結果、 ミリストイル基と疎水性アミノ酸との間に150個近いNOEが観測され(図1)、結合部 位の特定を助けた。Ca2+非存在下のリカバリンの構造計算は、3679個のNMR情報を用いて行なった。

3. リカバリンの三次元構造
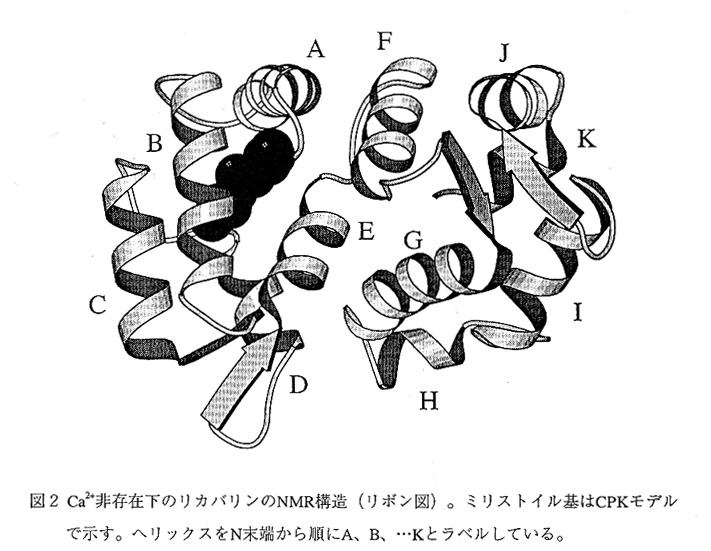
リカバリンは主にαヘリックスから構成され(図2)、EFハンド(ヘリックス-ルー プ-ヘリックスからなるCa2+結合モチーフ)が4つ存在する(N末端側からEF-1[B,C]、 EF-2[D,E]、EF-3[F,G]、EF-4[I,J]とする。[]内は各EFハンドを構成するヘリックス名)。 EF-1とEF-2、そしてEF-3とEF-4がそれぞれドメインを形成している点では、ガルモデュ リンやトロポニンCと良く似ているが、リカバリンではドメイン間のリンカーは大きく 折れ曲がり、2つのドメインはコンパクトにパッキングしている。面白いことに、EF-1 とEF-4はCa2+を結合するために必要なアミノ酸を欠いており、Ca2+を結合することが出来るのは、ドメインのインターフェイスを形作るEF-2とEF-3だけである5,8)。
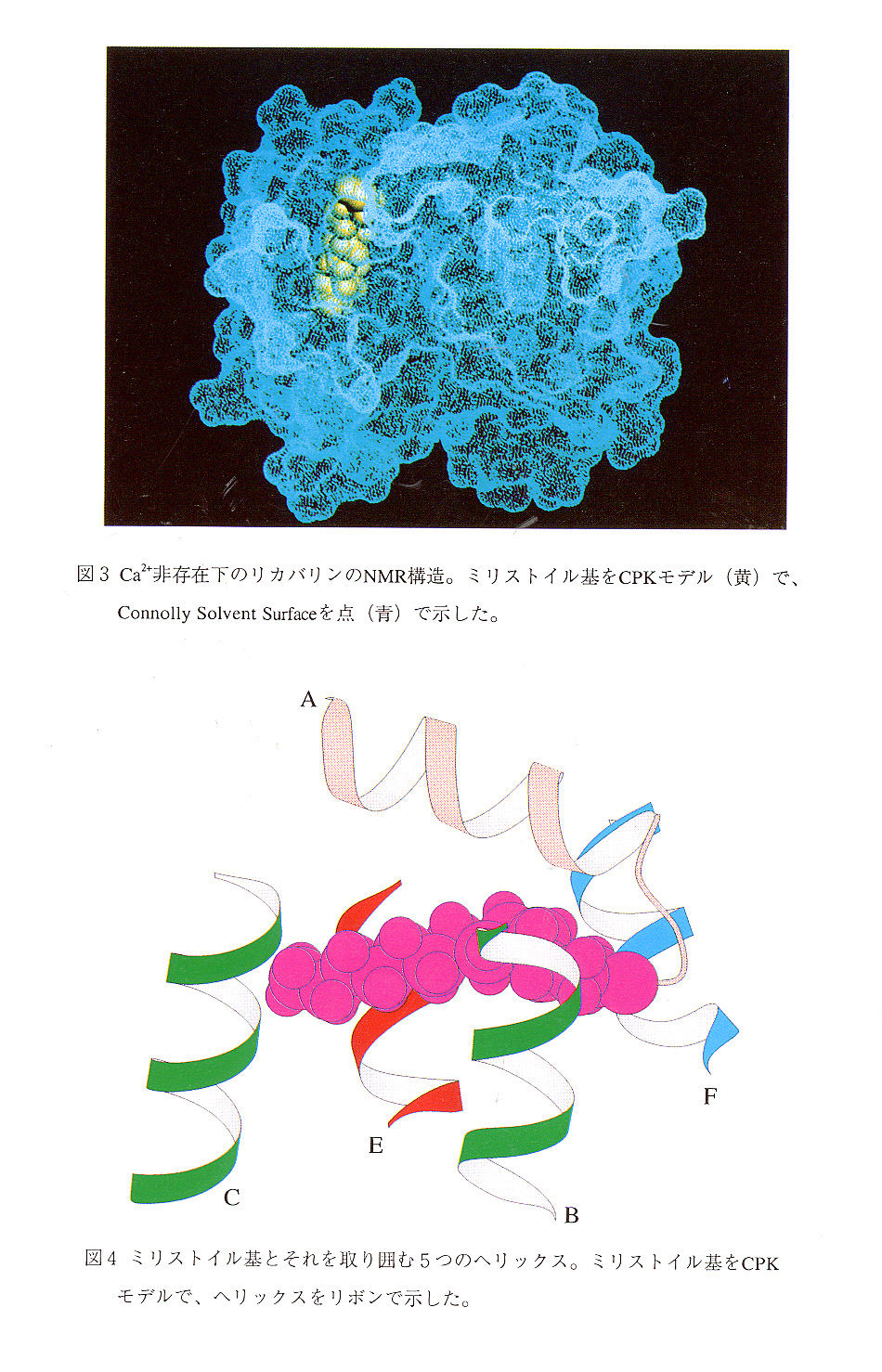
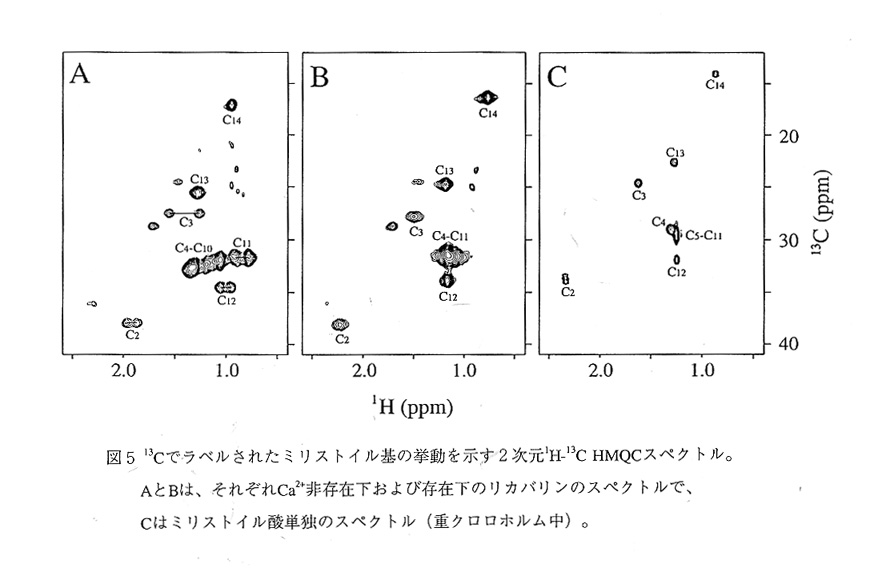
問題のミリストイル基は、タンパク質のN末端ドメインにある深い疎水性ポケットに 格納されており、ほんの一部しかタンパク質表面には出ていない(図2,3)。この構 造から、Ca2+非存在下では、ミリストイル基が細胞膜との相互作用に寄与出来ないこと が容易に理解される。また、このポケットは5つのヘリックス(A,B,C,E,F)から形 成され(図4)、これらのヘリックス由来の多くの疎水性アミノ酸残基(図1参照)が ミリストイル基を取り囲んでいる。このポケットは、ミリストイル基の結合部位である とともにN末端ドメインの疎水性コアでもある。したがって、ミリストイル基がこのド メインの構造安定性にも大きく関与していると考えられる。
4.カルシウムによる構造変化
さて、Ca2+が結合すると、ミリストイル基はタンパク質表面に露出されるのであろうか?この疑問に答えるために、ミリストイル基のみが13Cでラベルされたリカバリンを用 い、Ca2+の結合によるミリストイル基の挙動をNMRで調べた9)。Ca2+非結合状態では、2,3,11および12位のメチレンプロトンの化学シフトはそれぞれ非等価であり、2つのピ ークが観測される(図5A)。これは、上述したように、ポケットの中のミリストイル 基が、周りを取り囲む芳香族アミノ酸の影響を受けているためと考えられる。しかし、 Ca2+が結合するとこのスプリッティングは無くなってしまい(図5B)、重クロロホル ム中で測定したミリストイル酸単独のスペクトル(図5C)と非常に良く似たものとな る。すなわち、タンパク質の中にしまいこまれていたミリストイル基は、Ca2+の結合に よってタンパク質表面に露出されるのである。
タンパク質はCa2+の結合でどのような構造変化を起こすのであろうか?残念ながら、 Ca2+結合状態のリカバリンの構造はまだ解析中である。そこで、Ca2+を1個結合した、 ミリストイル基を持たないリカバリンの結晶構造5)と比べてみよう。この結晶では、Ca2+ はEF-3に結合している。両者のC末端ドメインは互いに非常に良く似ているが(主鎖の RMsD値は約2.2Å)、N末端ドメインはかなり異なる(主鎖のRMSD値は約6.9Å)。特 に、EF-1の2つのヘリックスの角度が、Ca2+非結合状態では169゚とほとんど平行である のに対して、結晶構造では108゚と直角に近い。これ以外のEFハンドでは、その差は1゚か ら16゚で、両状態でほとんど同じである。また、N末端のヘリックスAが、ミリストイル 基がポケットに結合していることによってCa2+非存在下では安定化されているのに対し、 結晶ではN末端の7残基は見えていない。さらに、結晶構造ではタンパク質表面に大き な疎水性のクレバスが存在しているが、Ca2+非結合状態ではそのような部位はない。こ のようにN末端ドメインだけ大きく構造が異なるのは、Ca2+非存在下で疎水性コアの中 心を占めているミリストイル基が、結晶構造(あるいはミリストイル基を露出した状態?) では無いことを考えると納得が行く。

また、特に興味深いのは、N末端とC末端のドメインの相対配置が両者で大きく異なっ ている点であり(図6)、これによりタンパク質全体の主鎖のRMSD値は約9.6Åと非常 に大きな値になる。この相対配置の違いは、EF-2がEF-3に対して約45゚回転していると 表現することが出来る。Ca2+非結合状態ではヘリックスEがEF-3に挟みこまれて抑えられ ていたのに対し、1個のCa2+を結合した結晶ではヘリックスDがその位置を占め、ヘリッ クスEを追い出している。その余波で、ヘリックスAはEF-3のヘリックスFとコンタクト を取れなくなり、結晶構造ではタンパク質の他の部分との相互作用があまり持てない状 態になっている。これは、Ca2+結合状態で、ミリストイル基がタンパク質表面でぶらぶ らするのに都合が良さそうである。もちろん、2個のCa2+を結合した、ミリストイル基 を持つリカバリンの構造解析の結果を待たなければならないが、このCa2+結合によるド メイン間のねじれが、ミリストイル基露出の引き金と言えそうである。このことは、ド メインのインターフェイスを形成しているEF-2とEF-3にだけCa2+が結合することとも良 く符号する。
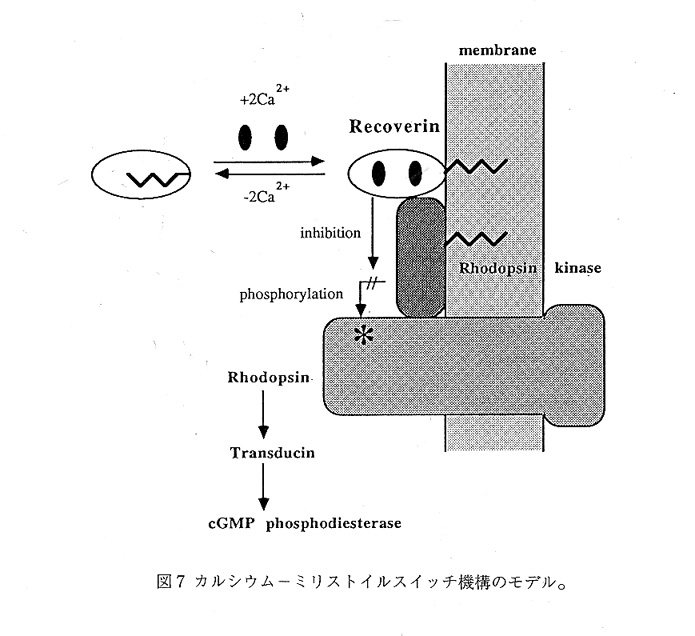
以上のNMR解析の結果から、図7に示すようなカルシウム−ミリストイルスイッチ機 構が考えられる。このようなスイッチ機構は、神経系にも存在するリカバリンファミリ ーのタンパク質に共通の特徴であろう。細胞膜におけるシグナル伝達機構の重要性はこ こで特記する必要もないが、これに細胞内Ca2+イオンがカップルする時に、カルシウム ーミリストイルスイッチは一般的な機構がもしれない。とりわけ7回膜貫通型レセプタ ーの活性が、Ca2+イオン依存的なリン酸化/脱リン酸化によって調節されているケース では、リカバリンファミリーのタンパク質が仲介している可能性が十分考えられる。
本稿で紹介した研究成果は、伊倉光彦教授、Lubert Stryer教授(Stanford University)およびJames Ames博士(Stanford University)との共同研究により得られたものである。
文献