低温実験の第二の福音は、何といっても、蛋白質結晶の放射線損傷を低減させるこ とである。一方で、低温下での結晶構造解析は、反応中間体の構造解析、水和構造 解析、蛋白質の熱膨張といった、蛋白質の構造と機能の相関をより詳細に検討するた めの物理化学的基盤を提供することが可能である。第三回は、これまでに筆者らが関 与した低温実験の幾つかについてまとめてみたい。
1. 二トリルヒドラターゼ六方晶系結晶の低温下での放射線損傷低減
Rhodococcus sp.N-771 株により産生される光応答性酵素ニトリルヒドラターゼは 暗条件下で不活性な状態で発現されるが、光照射によって瞬時に活性化されて、ニト リル化合物をアミド化合物に変換する機能を獲得する1)。この光応答性と触媒機構を分子レベルで解明するために、理化学研究所の生化学システム、結晶学、生物物理研究室が共同して、本酵素のX線結晶構造解析が進行中である2)。
不活性状態のニトリルヒドラターゼは硫酸アンモニウムを用いて斜方晶系結晶と 六方晶系結晶の二種類に結晶化される。斜方晶系結晶は放射線損傷の程度も小さく、 通常の構造解析に十分耐えうる結晶である。一方、六方晶系結晶は非常に放射線損傷 が顕著であり、室温での回折強度データ収集は不可能であるといってもよい。ここで は、放射線損傷を起こしやすい六方晶系結晶に対する回折強度データ収集の経過につ いて記述する2)。
六方晶系結晶は、実験室系での回転対陰極、集光光学系、イメージングプレート回 折計を用いた回折実験で、1時間の静止露光を行っても5Å程度までの回折斑点しか 観測されない。また、放射光実験施設のBL18B3)でワイセンベルグ法にてデータ収集を行った結果、X線露光開始当初は3.5Å程度の反射が観測されるものの、軸 立てのための数回の露光で分解能が5Åまで低下してしまうことが明らかにされた。 これらの結果は、六方晶系結晶が、X線照射によって急速にその結晶性を失うことを 示すとともに、放射線損傷さえ無ければ、通常の構造解析が可能であるという期待を 抱かせるものでもあった。
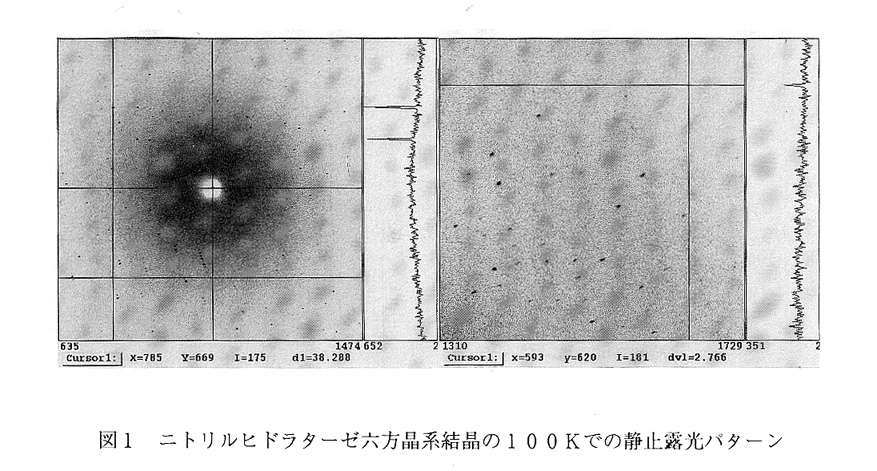
低温実験にて放射線損傷低減すべく、透析法による抗凍結剤の結晶母液への導入、 フラッシュ冷却による結晶冷却を経て4)、低温回折実験が行われることになった。六方晶系結晶が硫酸アンモニウムで析出しているため、まず、グリセロールを抗凍結剤に採用することとした。ミクロセルを用いた透析により、結晶母液を2.2M硫 酸アンモニウム、グリセロール22%(w/v)溶液に置換した。この溶液での薬剤 濃度の選択は、透析に先立って行われた結晶母液の冷却実験から決定されていた。 12時間の透析を経ても顕微鏡下では結晶の溶解や損傷は見られなかった。直径 700μmの石英キャピラリーを100μmの高さに切断した結晶マウント具を使用 して結晶をすくいとり5)、100Kに制御された低温窒素ガスにてフラッシュ冷却した。結晶は小ぶりで幅100μm、長さ500μmのエンピツ状であった。まず、結 晶方位を決定するために1時間の静止露光を幾つかの角度で行った結果、驚くべきこ とに、そこには、放射光実験でさえ観測されることの無かった分解能2.6Åの回折 斑点が記録されていた(図1)。即ち、ニトリルヒドラターゼ六方晶系結晶は、室温 でX線露光を行うまでは、比較的良質な結晶であったと言えよう。この結晶の2軸は 286.5Åと長いため、3.OÅ分解能までのデータ収集を行うこととした。我々 の実験室の光学系のX線強度と振動結晶法での回折斑点のオーバーラップを考慮し た場合、O.75度/1.5時間の振動露光が適当であった。表1のように軸立てを 行った場合、逆空間の独立な領域の反射を収集するには90度の回転が必須である。

286.5Åの反射が分離されており、抗凍結剤の導入や急速冷却によるダメージが無い ことが明らかである。矢印で示す回折斑点は、2.7A分解能である。露光時間は1 時間であった。
これは、X線露光回数にして、120回、露光時間にして約一週間に相当する。一週 問後にデータ収集を完了し、放射線損傷の程度を見るために最初の静止露見と同じ条 件で露光を行った結果、依然として分解能2.6Åまで回折斑点が存在しており、低 温実験の威力を実感した次第である。データ処理を行った結果、3.0Å分解能まで で91.6%の完全性であった。吸収効果の補正を行わない場合の反射データの統計 は表に示してある。
2.トリプシンの水和構造解析
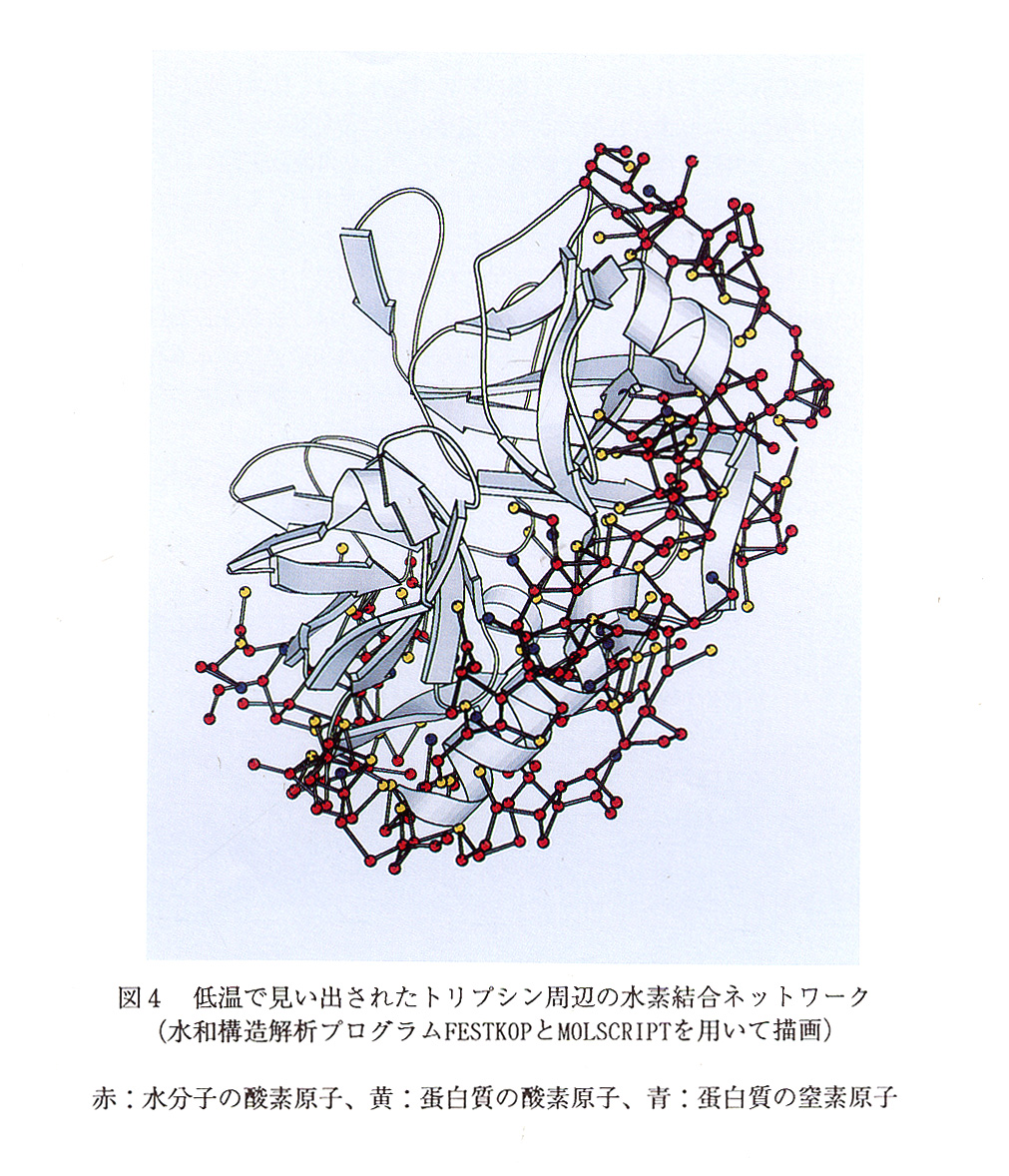
蛋白質水系における水分子の物理化学的役割については、中性子非干渉性非弾性 散乱や紫外可視、赤外分光実験、分子動力学計算によって知見が蓄積されつつあるが、 構造解析に基づいた水和に関する情報はいま一つ少ないのが現状である。水和構造デ ータの少なさは、ひとえに結晶構造解析で観測しうる対象が時問的空間的に固定され たものに限られるからに他ならない。この困難を克服する上で水分子の運動を凍結 して見ることのできる低温X線結晶構造解析法による水和構造解析が行われている。 測定対象にはありふれた酵素であるトリプシンが選ばれた。結晶内での分子間接触の 影響を極力排除した水和構造の検討を可能とするため、斜方晶系結晶二種[L form6) とH fom7)]三方晶系結晶一種[T fom8)]に対する低温X線回折実験を100 Kで行っている(表1)。
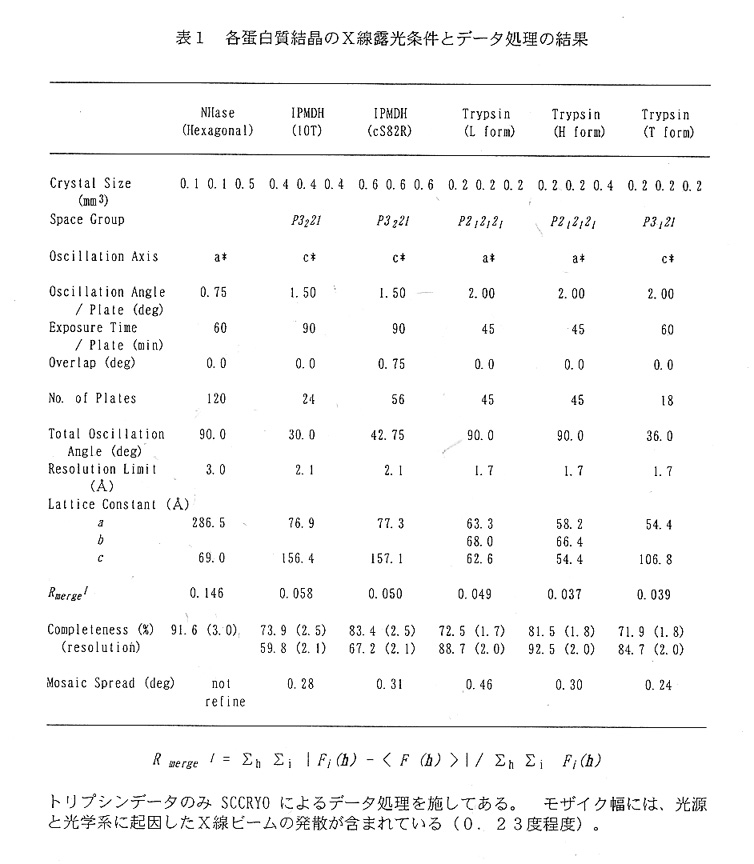
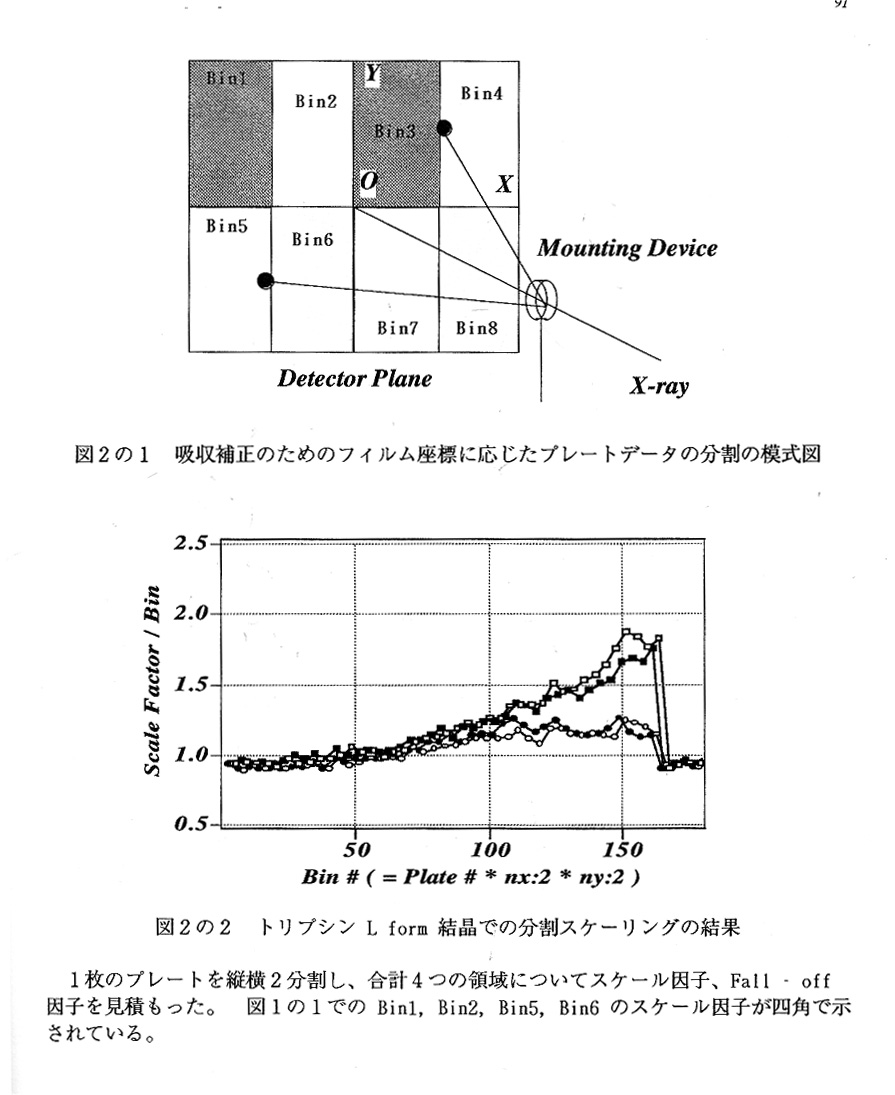
硫酸アンモニウム2.2Mを主成分とする結晶母液には抗凍結剤としてショ糖 26%を透析法によって導入している。硫酸アンモニウム系の結晶母液にはグリセロ ールが多用されているが、今回のショ糖の採用は、トリプシン結晶はグリセロール存 在下で溶解してしまうための措置である。結晶の初期冷却は、低温窒素ガスによるフ. ラッシュ冷却法によっている。結晶マウントには、様々な種類の器具を試みたが、現 在のところ、結晶の乾燥防止に優れた金魚すくい型マウント具(スライスキャヒラリ ーまたはハンプトンリサーチ社の製品)を使用している。データ収集後の強度データ のスケーリングでは、マウント具に存在する高濃度硫酸アンモニウム吸収効果を補正 するために、各プレートの回折斑点をその出現位置に応じて分割する操作を施してい る(プログラムSCCRYO)4)(表1、図2)。
いずれの晶系でも参照として室温下での回折実験を行い、合計6つの物理的に異な る状態について構造モデルを構築した。水分子の酸素原子は、構造精密化過程の差フ ーリエ解析にて位置を同定し、オミット電子密度図によって確認を行った。
トリプシン自体の構造は、低温下で大きく変化することはなく、どの結晶系でも線 膨張係数は、25×10-6 K-1と見積もられた。すでに報告されているミオグ ロビンの膨張係数の1/5程度の値であるが、この原因は、二次構造の相違に起因す るものと推察された9)。膨張ベクトルの空間相関関数は、100Kから293Kの温 度上昇の問に、比較的協同的な運動が生じたと解釈されるものであった。また、いわ ゆる低温変性は今のところ観測されたことが無い。
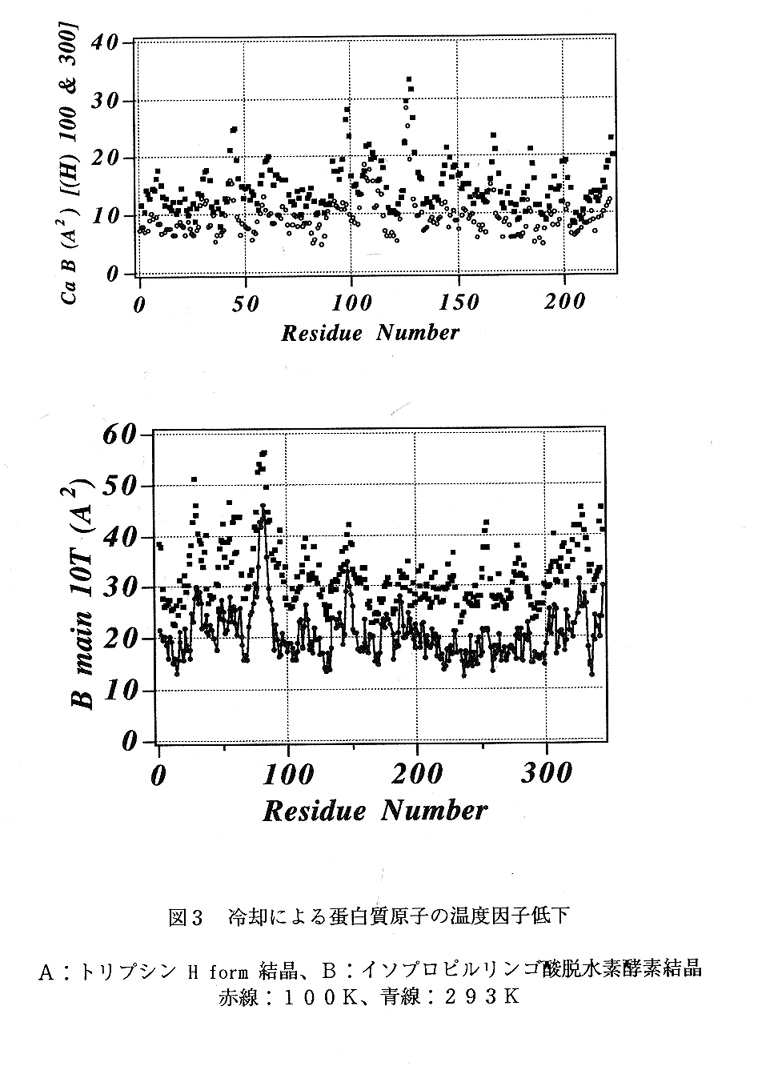
100Kでは、結晶学的非対称単位に含まれる水和本数は、室温実験の1.6から 2.1倍に増加しており、特に、蛋白質と直接相互作用できる距離にある水和本数の 増加が際立っていた。低温下での水和本数の増加は、低温実験の水和水同定での有効 性を如実に物語るものである。室温で見い出された水分子が必ず低温で見い出され ているわけではなく、水分子の位置の保存性はL formで75%であった。常に水 分子が存在する水和サイトは蛋白質分子内部、蛋白質表面から内部に陥入した領域に 多く見い出され、その他の領域の水和サイトは、確率的に占有されている可能性が高 い。蛋白質の温度因子は、十分に低下しておらず(図3)、更に急速な冷却を試み た場合との比較が待たれている。
X線小角散乱実験で得られる低分子量蛋白質の慣性半径は、結晶解析で得られた座 標から計算されるものより1Å程度大きめの値を示すことが多い。しかし、低温で見 い出された水分子を慣性半径の計算で考慮に入れると、小角散乱実験で得られる慣性 半径の値は、無理なく説明することが可能であり、水溶液中でも常に100Kで観測 された程度の水和水がトリプシンに付随することが示唆された。
親水性原子に対する水和の形態は室温下での構造解析結果と同じであり、親水性原 子の量子化学的状態を反映したものであった。100Kでは、293Kでは滅多に観 測できない表面に露出したアラニンやバリン残基側鎖の水和形態(疎水水和)も明ら かとなった。疎水性分子の水和では、親水性分子の水和より多くの水が強固な水素 結合を形成していると理論的に予測されているが(疎水水和)、低温下で見い出され たアラニンの水和には、少なくとも5個の水分子が関与し、疎水水和理論を裏付ける 結果となっている。
蛋白質表面での水分子配置を詳細に調べた結果、複数の三角形、四角形や五角形の 配置をとる水分子のクラスターが見い出されている。このようなクラスターの存在は、。 蛋白質表面においてもなお、水独自のダイナミクスが維持されていることをしめすも のである。構造モデル中の任意の水分子から水素結合をたどってみると、巨大な水素 結合性クラスターが蛋白質を覆っていることが明らかとなった。見い出された最大の クラスターでは、150個の蛋白質原子と、226個の水分子が含まれる。,p> 蛋白質を覆い尽くす巨大なクラスターの存在は、蛋白質全体にわたる揺らぎを支配 する低振動数モードに大きな影響を及ぼすものと考えられる(図4)。
紙数が限られているので全てを記すことはできないが、これらの他にも、
等の回折強度データ収集やテスト露光が低温下で行われている。
3.現状と将来
現在、理化学研究所では、所内の生物科学研究棟に蛋白質X線結晶解析専用の実験 室が設けられるに至り、さまざまな蛋白質の構造解析が着々と進行している。この実 験室では、放射線損傷の大きな蛋白質結晶に出会った場合、即座に、低温実験マニュ アル4)に従った操作が行われ、定常的な低温実験の実施が可能となっている。実験の 中核となるのは、低温ガス吹き付け装置であるが、定常的な実験が可能になるのは、 自作の液化ガスへの投下装置、細胞凍結保存容器、結晶マウント具、試料周りの消耗 品目の開発が地道に行われるとともに、常に、抗凍結剤条件の探索が行われているこ とによっている・低温実験の開発は地道な努力と、日常の観察がものを言う場合が 多い。淡泊な実験者には向かないかもしれないが、しつこく実験を繰り返し試して 見ることが不可欠であろう。
現在・特に、克服すべき問題として、希望の温度でのX線回折実験を如何に簡便に 行うかがある。水を大量に含む結晶化溶媒の性質上、100Kでガラス状で凍結して も、温度上昇とともに通常のHexagonal Ice Phaseが出現する。この出現をどのよ うにして回避するか問題は非常に難解である。
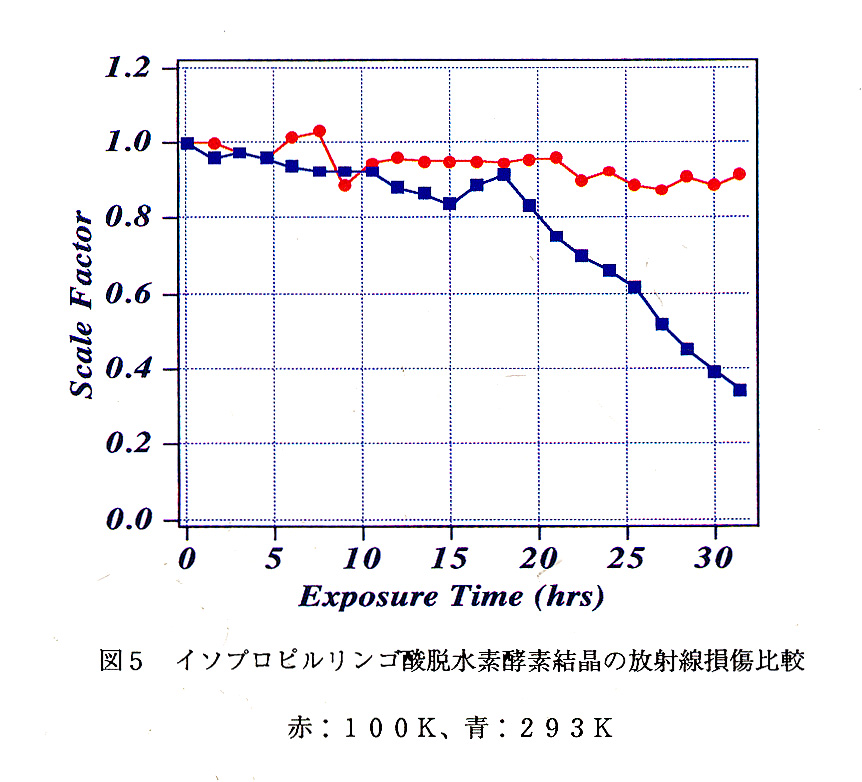
ここに掲げたニトリルヒドラターゼ結晶の回折実験は、理化学研究所生化学システ ム研究室の長島重広博士、養三田正文博士、尾高雅文博士、遠藤勲主任研究員、結晶 学研究室の神谷信夫博士との共同実験として行われた。また、イソプロピルリンゴ 酸脱水素酵素結晶の低温実験は、東工大生命理工の田中信夫教授、永田親広博士とと もに行った。
参考文献
