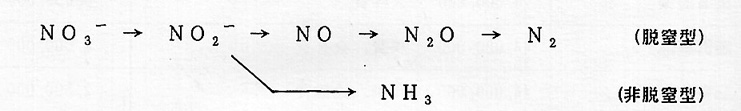
はじめに
地球上では生命体が利用する様々な物質(元素)の循環が成立しているが、窒素 サイクルもそのような物質循環の一つである。窒素は蛋白質や核酸などに大量に含 まれ、生体を構成する主要元素の一つとして重要である,生物界への窒素の供給源 は大気中の窒素ガス(N2)であるが、この反応(窒素固定)には莫大なエネルギーが必要である。従って窒素の供給は限られ、多くの生態系における生物の生育制限 因子となっている。脱窒(denitirification)とは硝酸などの酸化窒素が還元され、 N2や亜酸化窒素ガス(N2O)などの気体となって大気中に放出される現象である。
脱窒は窒素固定の逆反応として、窒素サイクルを完結させる重要な過程である。 脱窒は生理的には、硝酸を初めとする一連の酸化窒素を最終電子受容体とする呼 吸として機能している,すなわち脱窒反応は生体エネルギー(ATP)生成と共役 している。このように、分子状酸素以外の物質を最終電子受容体とする呼吸を嫌気 呼吸と総称する。硝酸等の酸化窒素以外に、硫酸等の酸化イオウ、フマル酸、トリ メチルアミンNーオキシド(TMANO)などを電子受容体とする嫌気呼吸が知ら れており、それぞれ硝酸呼吸(あるいは異化型硝酸還元)、硫酸呼吸などと呼ばれ る。硝酸呼吸はさらに、N2を生成する脱窒型とアンモニアなどを生成する非脱窒型に分類できる。
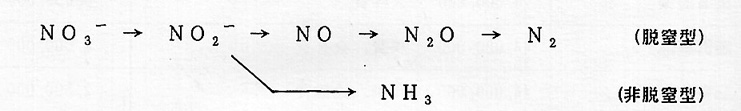
脱窒型硝酸呼吸系は、Paracoccus denitrificans、Pseudomonas stutzeriなどきわめ て多数の細菌に存在が認められている。一方非脱窒型硝酸呼吸は、大腸菌 (Escherichia coli)など腸内細菌に見出される。上記の様に完全な脱窒系は4段階 の還元反応より成り、それぞれに固有の還元酵素が関与する。各還元反応の電子供 与体は呼吸鎖電子伝達系である。
硝酸呼吸、硫酸呼吸などの嫌気呼吸は長い問、原核生物(細菌)しか行わないと 信じられてきた。しかし近年私共の研究室において、Fusarium oxysporum、 Cylindrocarpon tonkinenseなど幾つもの真菌(カビ)に明瞭な脱窒活性が見出され た。多くの方は、カビも細菌もどちらも似たような汚いバイ菌と思われるであろう が、生物の分類上両者には真核生物と原核生物という大きな隔たりかある。上記の ように細菌の脱窒系は多くの構成成分より成る。カビと細菌の脱窒系の比較は生命 進化を考える上でも興味深く、我々は現在、カビ脱窒系の構成成分などの解明を行っ ている。これまでの成果を紹介したい。
細菌硝酸呼吸系の構成成分
脱窒の研究は古くより行われているが、分子生物学的研究の進展か見られたのは ここ10年足らずの間である。窒素サイクルのような無機物質の代謝には金属蛋白 質が童要な役割を果たしている。細菌硝酸呼吸系は発現調節系も含めるときわめて 多数の構成成分より成るか、主要なものはすべて金届蛋白質である。上記脱窒の4 段階の還元反応はそれぞれ、硝酸塩還元酵素(Nar)、亜硝酸塩還元酵素(Ni r)、一酸化窒素還元酵素(Nor)、および亜酸化窒素還元酵素(Nos)に より行われる。生理的電子供与体はNarがユビキノールで、他の3酵素はシトク ロムc、アズリン、シユードアズリンなどであるとされる。
Narは硝酸呼吸の最初の反応である硝酸から亜硝酸への2電子還元を触媒する。 生理的電子供与体はユビキノールである。活性中心はモリブデンコファクターをも つ。その他に、シトクロムbおよび鉄ーイオウクラスターをそれそれもつサブユニッ トから成る。脱窒型および非脱窒型(大腸菌)硝酸呼吸を行う細菌に共通に見られ、 互いによく似ているようである。シトクロムb成分が膜貫通型て、モリブテンコファ クターをもつ活性中心サブユニットは細胞質側を向いている。最近 P.denitrificans などの脱窒細菌に、この膜結合性Narとは異なる1硝酸塩還元酵素(Nap)の存 在が明らかとなった。 Napはペリブラズム(外膜と細胞質膜の間のスペース)に 局在する可溶性タンパクで、ATP生成とは共役しない。
脱窒細菌のNirは亜硝酸を1電子還元し、一酸化窒素(NO)を生じる。シト クロムcおよびdをもつヘム蛋白質と、銅含有蛋白質とに大別される。銅含有Ni rはさらに青色Nirと緑色Nirに分類される。銅含有Nirは3量体のユニー クな構遣をとり、各サブユニットはそれそれタイブ1およびタイブ2の銅2原子を もつ。色の違いはタイブ1銅のリガンドの違いによる.ペリブラズムに局在する可 溶性タンパクで、電子供与体はアズリン、シユードアズリン、シトクロムcなどで ある。一方大腸菌の非脱窒型Nirは亜硝酸を一気に6電子i還元し、アンモニアを 生じる。この非脱窒型の異化型Nirは、シトクロムc含有サブユニットのヘキサ マーと考えられる。
Norは2分子のNOから亜酸化窒素(N2O)を生じる。膜貫通型タンパクで あり、シトクロムbおよびcをもつサブユニット2個より成る。シトクロムbはさ らに金属(おそらく鉄)をもつ。
Nosは銅含有蛋白質で、アセチレンにより阻害される。
この他、大腸菌ではギ酸脱水素酵素(Fdh)がNarと共に誘導される。ユ ビキノンを電子受容体とし、Narへの電子供与系として働く,モリブデンコファ クター、鉄一イオウクラスターをもつ。脱窒細菌では知られていない。また多くの 脱窒細菌には低分子の銅タンパクであるアズリン(青色)あるいはシユードアズ リン(緑色)が見出される。ペリブラズムに局在し、Na r以外の還元酵素への電 子供与体であると考えられている。
硝酸呼吸系は基本的に適応系である.すなわち、周囲の酸素分圧が低く(酸素が 多いと酸素呼吸が優先する)、なおかつ脱窒基質(硝酸、亜硝酸など)が存在する 時に初めて誘導される。酸素のセンサーとして、FNR(Fumarate and Nitrate Reduction)が大腸菌でよく調べられている。FNRは鉄を含むDNA結合蛋白質で、 硝酸呼吸系のへ発現調節を転写レベルで行う。FNRは多くの脱窒細菌にも存在す るようである。硝酸の検出系としてNa r Lなどのセンサー・レギュレーターシス テムが大腸菌でよく調べられているが、脱窒細菌では殆ど何も分かっていない。
カビ脱窒系の構成成分
2種の脱窒真菌 Fusarium oxysporum および Cylindrocarpon tonkinenseについ て詳しく調べている。カビ脱窒系はNosを欠き、従って脱窒の最終産物はN2Oで ある。N2を生じるカビ脱窒系は未だ見つかっていない。さらにC.tonkinenseはN arも欠き、硝酸を還元できない。このような、還元酵素の一部欠落は細菌の硝酸 呼吸系にもよく見られるが、カビ脱窒系の最大の特徴は、シトクロムP450の関与 である。F.oxysporumの脱窒成分について述べる。
F.oxysporum からはNir、Nor、およびアズリンを完全精製し、Narもほ ぼ精製できた。Narは大腸菌や脱窒細菌のものとよく似ていると思われる。すな わちモリブデンコファクター、鉄ーイオウクラスター、およびシトクロムbをそれ ぞれ有する3種のサブユニットより成る膜タンパクで、ユビキノールを電子供与体 とする。面白いことに、大腸菌に存在し、脱窒細菌では知られていないFdh(電 子受容体、ユビキノン)が存在する。Nirは青色銅タンパクである。さらにアズ リンが存在し、Nirへの電子供与体となる。NorはシトクロムP450(P45 0nor)で、NADHから直接電子を受け取り、呼吸鎖電子伝達系には直結していな い。カビと細菌の脱窒系主要成分を表1にまとめた。大腸菌(非脱窒型)、脱窒細 菌、およびカビ(F.oxysporum)の硝酸呼吸系を比べると、共通に見られる成分は Narのみである。カビは脱窒型であるにも関わらず、ユビキノンを電子受容体と するFdhを持つ。一方Nirおよびアズリンは脱窒細菌のものに酷似する。P45 0norは細菌では知られていない。こうして見ると、カビ脱窒系は幾つかの硝酸呼 吸系の成分の寄せ集め(medley)に思える。このように脱窒系は金属タンパ クを中心とした多くの構成成分より成り、結晶解析の材料の宝庫である。
カビ脱窒系の細胞内局在とATP生成との共役
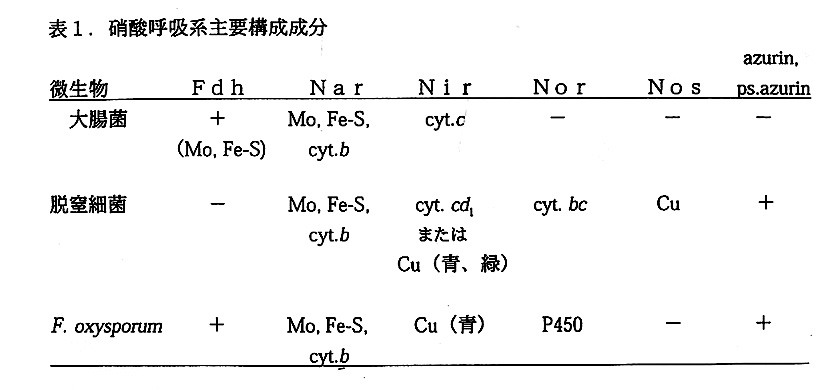
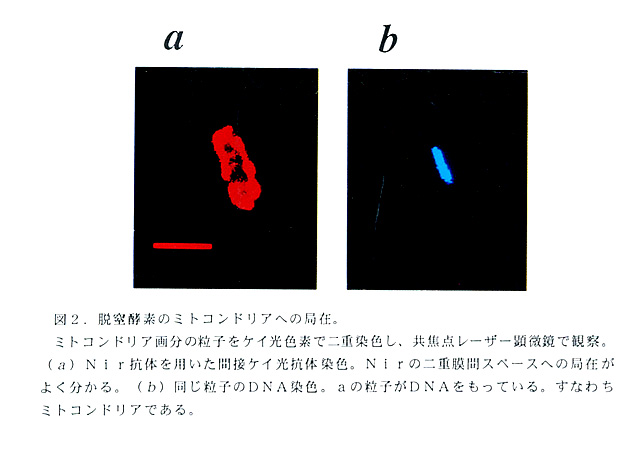
カビに脱窒活性か見つかれば次に、カビの脱窒が細菌と同様に嫌気呼吸として働 いているのであろうか、またそうであるならその活動部位は好気的呼吸と同様に真 核生物の呼吸器官であるミトコンドリアであろうか、という当然かつきわめて興味 深い疑問を誰しも持つであろう。答えはどちらもイエスである。F.oxysporumおよ び C.tonkinenseのNarあるいはNir活性の細胞内局在を調べると、いずれも ミトコンドリアと思われる粗粒子画分に多く存在した。しかもその活性にはピルビ ン酸、リンゴ酸、コハク酸などの呼吸基質か電子供与体として有効であった。さら にそのNarあるいはNir活性に共役してATPの合成が観察された(図1). F.oxysporumのミトコンドリア画分の粒子は、抗Nir抗体を用いた間接ケイ光抗 体染色およびDNA染色の二重染色に反応した(図2)。これらの結果は、カビ脱 窒系がミトコンドリアに局在し、嫌気呼吸として働いていることを示す。
シトクロムP450norのユニークな反応機構
シトクロムP450(P450)は哺乳類や植物などの高等生物から細菌にいた る多くの生物に普遍的に見いだされ、無数の生体反応に関与する一群のヘム蛋白質 である,P450は通常モノオキシゲナーゼとして機能するが、カビの脱窒に一酸 化窒素還元酵素として関与するP450norは非常にユニークな反応を触l媒する (下式:SHは有機物の基質)。NOはP450その他のオキシケナーゼの阻害剤 として知られているか、P450norはNOを基質にする。
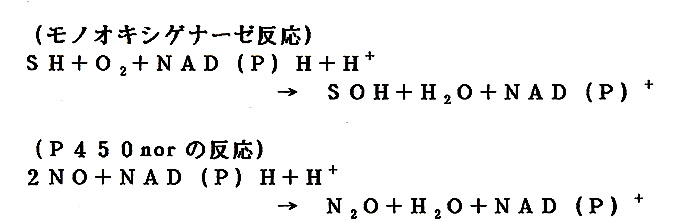
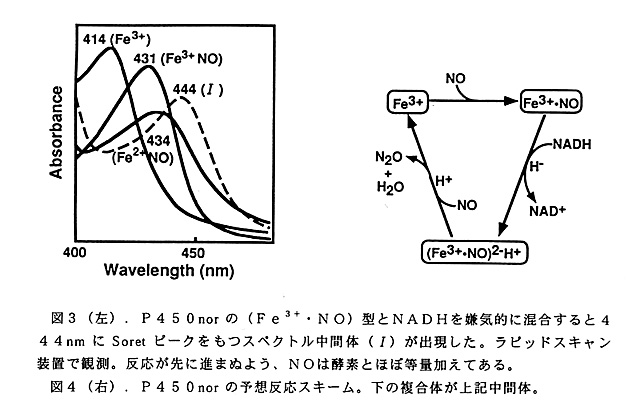
またP450などのへ ム蛋白質や他の金属蛋白質などの1電子酸化還元中心へのNADH(NADPH) からの電子伝達には、通常フラビン蛋白質など他の成分の助けを必要とする。とこ ろがP450norは単独で上記反応を行う。すなわちP450norがNADHから直 接電子を受け取ると思われる。P450norはF.oxysporumおよび C. tonkinenseから得られている。後者には電子供与体(NADH,NADPH)ヘの 特異性が異なる2種のアイソザイム、P450nor1およびP450nor2、が存在す る。面白いことに、F.oxysporumのP450norとC.tonkinenseのP450nor 1はNADHに、C.tonkinenseのP450nor2はNADPHに特異的である,こ の事実は、P450norがNADHとNADPHを見分けることができることを意 味する。すなわちその分子中にNAD(P)Hの結合部位が存在する筈である。 P450norのオーバーオール反応は10℃で1,000s-1以上ときわめて速 く、拡散律速に近い,ラピッドスキャン法で各部分反応を観察した。嫌気条件下で 休止状態(Fe3+)のP450norとNADHを混合してもヘムの還元は起こらな い。しかし基質であるNO存在Tでは速やかにNADHによる還元を受け、444 nmにソーレーピークを持つスペクトル中問体が出現した(図3)。この還元速度 はオーバーオール反応に比べ遅くなく、従ってこのスペクトル中間体は反応中間体 であり、酸化型ヘム・NO複合体(Fe3+・NO)が2電子還元されたものと考え ている。この結果から本酵素反応のスキームを考えた(図4)。中問体の同走と複 合体(Fe3+・NO)ヘの2電子伝達機構の解明が、反応メカニズムの面からの今 後の最も興味深い課題である。
P450norのX線結晶構造解析
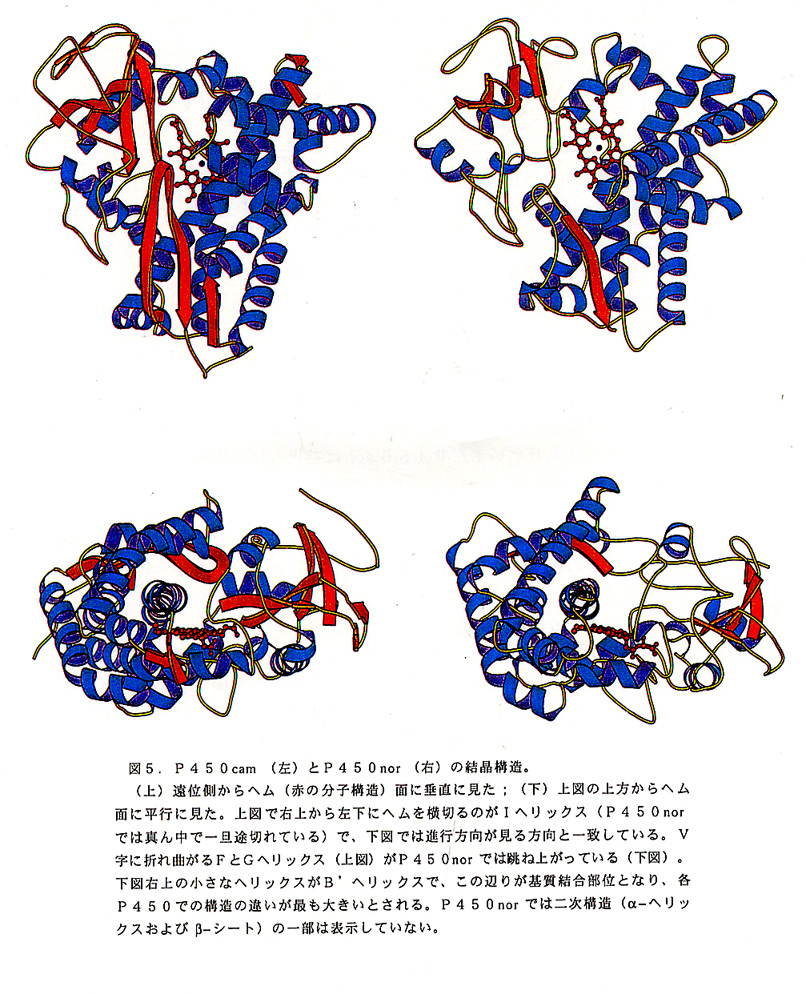
異なるファミリーに属するP450同士のアミノ酸配列の相同性は、通常それほ ど高くない(15%前後)。それにも関わらず全てのP450は似たような立体構 造をとっていると考えられている。P450norは特異な反応機構をもつにも関わ らず、そのアミノ酸一次配列は他のP450と相同性を示す。すなわちP450スー パーファミリーに属する。従ってその立体構造の他のP450との比較は実に興味 深い。最近そのX線結晶構造解析に成功した。P450はこれまて4種類で結晶構 造が明らかにされている。細菌のP450camは最初に構造解析がなされ、メカニ ズムの研究も最も多くなされている。モノオキシゲナーゼP450の代表としての P450camとP450norの構造を比較した(図5)。両者のアミノ酸配列相同 性は20%余りである。上記反応式からも分かるように、両者の反応機構は随分と 違う。P450norには有機物の基質がなく、NADHから直接電子を受け取る, 一方P450camは有機物の基質(カンファー)結合部位をもち、直接の電子供与 体は蛋白質(フェレドキシン)である。このように反応機構の大きな違いにも関わ らず、両者の立体構造は驚くほどよく似ている。特にα-ヘリックスやβ-シートな どの2次構造はよく保たれている。P450においてもタンパク構造の一般則、1 次構造より高次構造の方かよく保存される、が当てはまる。P450においても、 ヘム第5配位子システインのある側をヘムの近位、逆の側を遠位というが、両者の 構造の最も大きな違いは遠位側に見られた。すなわちP450norの遠位側はP4 50camに比べてより開いた(オープンな)構造をとっている,このような構造は 他の物理化学的測定からも予想されていたが、予想以上に開いた構造をとっていた。 こちら側にNADH(またはNADPH)が結合すると予想しているが、もしそう であるならば、近位側から電子がヘムに渡る通常のP450とは逆の方向から電子 か渡ることになる。NAD(P)H結合部位に関しては現在、蛋白質工学的解析な ど他の方法でも検討している。
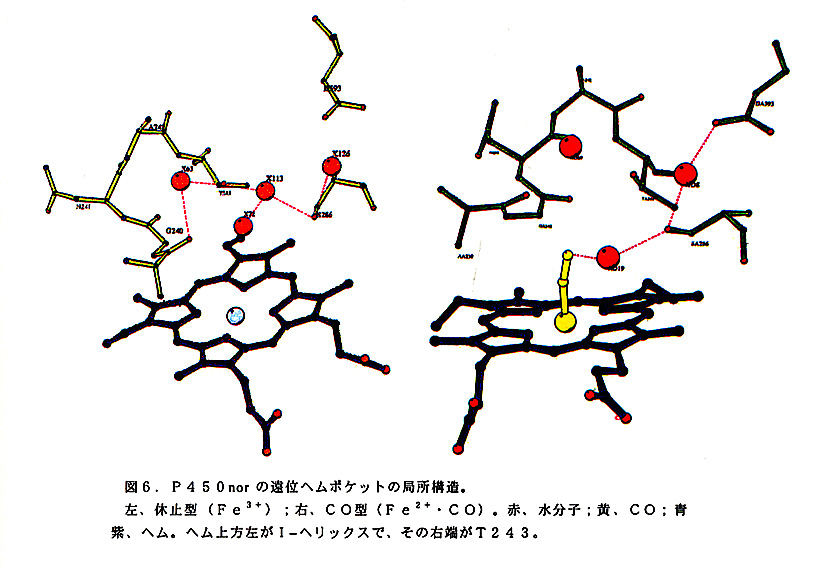
休止状態(Fe3+)と、それにNOが結合した複合体(Fe3+・NO)の結晶構 造の比較は興味深い。何故なら、前者てはNADHによるヘムの還元は起こらず、 基質が結合した後者て初めてNADHによりヘムが還元されるからである。NOの 結合によりどのようなConfigurationの違いが生しているのであろうか.残念なが ら(Fe3+)の結晶にNOを浸透させると結晶が壊れた,その代り、ヘムの電子状 態が(Fe3+・NO)と同じてある一酸化炭素との複合体(Fe2+・CO)の結晶 が得られた。(Fe3+)と(Fe2+・CO)の結晶構造を比較すると、ヘム周辺の 水分子に興味深い相違が観察された(図6)。ヘム遠位側には最長のIへリックス が、ヘム面に密着してヘムを横断している。その中程に殆どのP450に保存され ているスレオニン残基(P450norではT243)がある。またその隣のN末側に は多くの場合酸性アミノ酸(DまたはE)残基か存在するが、P450norでは Ala残基になっており注目される。通常のモノオキシゲナーゼP450の反応では、 これらのアミノ酸残基はプロトンドナーとして働くと考えられている。P450 norの(Fe3+)では、遠位側ヘム近傍に水4分子かあり、T243とも水素結合 している。一方(Fe2+・CO)型では水とアミノ酸側鎖との水素結合の様子はガ ラリと変り、ヘムに結合したCO分子近くの水からセリン残基(S286)、2分 子目の水、アスパラギン酸残基(D393)をつなぐ水素結合のネットワークか形 成されていた(図6)。このネットワークはさらに他の水分子などを通してタンパ ク表面近くにまて達していた,一方T243に結合した水分子は孤立していた.従っ て(Fe3+・NO)複合体においても同様の水素結合ネットワークが形成され、N ADHによる遺元の際プロトン供給系として機能することが予想される。このネッ トワークに含まれるセリン残基をバリンに変えた変異体(S286V)の活性が大 きく減少した(約5%)結果も、この予想を支持する。
P450のバイオダイバーシティー
P450とは実に不思議な蛋白質である。哺乳動物においては、肝臓などての解 毒や薬物代謝、ステロイド合成、アラキドン酸カスケードなどに関与し、また最近 注目のNO合成酵素(NOS)もP450の性質を示す。すなわち古くから主に医 学の分野で注目されてきた。一方近年、哺乳類以外のP450研究も盛んになって きた。例えば、植物の二次代謝産物は地上に20万種類も存在すると言われている が、それらの生合成の多くのステップにP450が関与すると考えられている.植 物の二次代謝産物の一部は、動物からの捕食に対抗するための毒である。一方動物 は植物の葉と一緒にその毒を食べても死なぬよう、解毒酵素P450を発展させて きた。すなわち両者とも進化の過程での生存競争において、P450を共通の武器 として戦ってきた(植物と動物の戦争)。この話は、P450が生物界に如何に広 く用いられているかを示す一例である。通常のP450はモノオキシゲナーゼとし ての機能をもつが、変わった反応を行う例としてP450nor以外に、プロスタグ ランティン異性化酵素とアレンオキサイド合成酵素(脱水反応)が知られる。このよ うにP450は、分子の種類だけでなく反応のバラエティーもある。一つの遺伝子産 物がP450のように、免疫にも匹敵すべき分子多様性(Molecular Diversity)を 獲得した例を他には知らない。何故P450はこのようなバイオダイバーシティーを 獲得できたのであろうか。蛋白質の分子進化の機構を解明する上で、P450の構 造解析はまたと無い研究テーマではないだろうか。P450のX線解析は未だ5種 ほどのの可溶性P450でなされたに過ぎない。P450分子進化の秘密を解くた めにもより多くの、ことに真核生物の膜結合性P450の構造解析が待たれる。
呼吸系の進化と脱窒
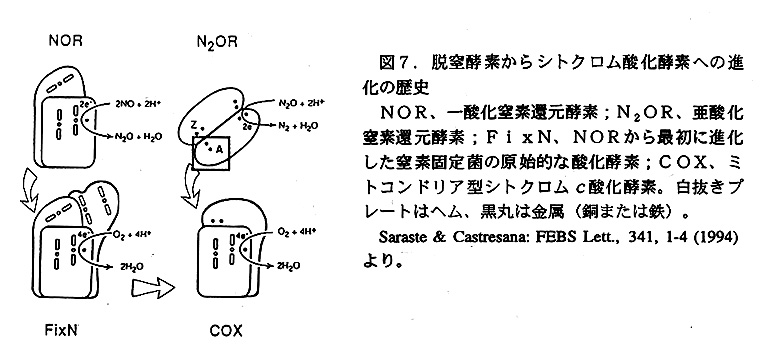
どのような生物も、その活動にエネギーが必要である。生物のエネルギー通貨 はATPで、その生産方法に光合成、呼吸、発酵の三種類がある,地上最初の生命 については誰しも興味をもつところであるが、そのエネルギー獲得手段はどの様な ものであったのたろうか。近年の徴生物化石の研究によると、これまで発見された 化石のうち素性が明らかにされた最古の生物は光合成細菌の一種である藍藻類(シ アノバクテリア)だそうである。36億年前の太古の生命が既に、現在の植物と同 様の酸素発生型光合成を行っていたとは少し意外な気がする。呼吸の進化に関して も、好気と嫌気のどちらが先にあったかという議論がある、大気への遊離酸素蓄積 がかなり後の出来事であるなら、嫌気呼吸先行説が一見有利に思えるが。この点に 関し、近年大きな進展が見られた酸素呼吸の末端酸化酵素、シトクロム酸化酵素 はその立体構造か本・坂部ブロジェクトの班員らにより初めて明らかにされ、話題 となったのはご承知の通りである。そのいくつかあるサブユニットのうちで最も重 要な、電子伝達中心を含むものはサブユニットⅠおよびⅡである。この二つのサ ブユニットはそれぞれ、細菌脱窒系のNorおよびNosとアミノ酸一次配列相同 性を示す。つまり酸素呼吸のためのシトクロム酸化酵素は、脱窒系酵素をその重要 部品として借用し作られたと思われるのである(図7)。従って酸素呼吸は硝酸呼 吸(脱窒)が進化して生じたと思われる。
真核生物は今から20~15億年前にかけて、複数の生物の共生により生じたとされる。ミトコンドリアや色素体(葉緑体)などのオルガネラ(細胞内小器官)はその時内部共生した細菌に由来する,呼吸鎖電子伝達系の成分や16SrRNAなどの比較によると、真核生物のミトコンドリアは現在の自由生活細菌の中では脱窒細菌 P.denitrificans に最も近い類縁関係にある.すなわち両者は共通の祖先をもつことになる。上記シトクロム酸化酵素の起源とミトコンドリアの起源の話は見事に一致する。すなわち真核生物誕生以前(20億年以上前)に脱窒細菌が周囲の遊離酸素濃度の上昇に適応し、脱窒系から酸素呼吸系を生み出したことになる。脱窒より酸素呼吸の方がエネルギー的に有利であるので、酸素分圧が一定以上ある環境では酸素呼吸が主力となり、脱窒は酸素分圧の低い環境で誘導される適応系となった。酸素呼吸能を獲得した脱窒細菌はまた真核生物の祖先と共生し、ミトコンドリアの元となった。
やがて多くの真核生物は一定の酸素分圧下で生活するようになり、ミトコンドリアの脱窒系は不要となり捨てられた。では真核生物であるカビのミトコンドリアに脱窒系が存在するという我々の結果は、どのように考えたらよいのであろうか。ミトコンドリアの遠い祖先がもっていた脱窒系を、一部のカビが綿々と保持してきたのであろうか。F.oxysporumのNirおよびアズリンのアミノ酸一次配列を一部決定したが、それら配列を種々の細菌の同一タンパクと比較した。すると驚くべきことに、Nir、アズリンともに細菌のタンパクと極めて高い(80-100%)配列相同性を示した。この高い配列相同性は、これらカビと細菌の銅タンパクが(20億年という年代と比べると)ごく最近分岐したことを意味する。生物種の分岐時期とそれら生物が持つ同一タンパク(すなわち遺伝子)の分岐時期が一致しない場合、その様な現象が生じる理由として、生物種分岐後に行われる異種生物問ての遺伝子交換(水平遺伝子伝達)を考える。異なる種間での遺伝子交換は、ことに真核生物では極めて少ない筈である。そのようなことが頻繁になされるならば、種と言うものが存続しないことになる。原核生物(細菌)から真核生物への水平遺伝子伝達の例としてかなり確かと思われるものは、β-ラクタム抗生物質(ペニシリンなど)合成遺伝子の放線菌からカビへの伝達など、ほんの1~2例しかない。カビ脱窒系遺伝子にはそのような可能性があ る。実はP450norも系統的に、真核生物由釆のP450でありながら細菌のP450グルーブに分類される唯一のものである。すなわちP450norはもともと細菌由来であることになる。Nirやアズリンなど、P450nor以外の脱窒系構成成分の遺伝子取得が待たれる。
生化学者から結品学者への期待
昨年10月の総会の折り講演をさせて戴きました。その際坂部先生より標記のようなテーマについて話すよう強いご要請がありました。仲々難しい題であり、当日うまくお話しできませんでしたので、少し追加させて戴きます。
生命現象も物理や化学の法則に従って営まれている、と我々は信しています。では生命の法則も、波動方程式のような物理化学の一般法則で100%説明できる日が来るでしょうか。我々生化学者は、そのような日は来ないと思っております。つまり生命の研究はエンドレスです。各時代の生命研究の進展は、解析手段のレベルに規制されます。このことは遺伝子操作技術の発明か生命科学の進展にどれ程貢献しているかを見れば明らかです。研究のための新しい技術は最初は単純な系を対象にして生まれ、その後より複雑な系に応用されます。分子生物学や遺伝子工学も最初は大腸菌を相手にして誕生し、現在では脳神経の解明を目指しております。今から10年程前、遺伝子工学は徴生物を主な研究対象とし、我々の応用微生物学も流行分野の一つでした。それが僅かの問に、流行は哺乳動物とくにヒトを対象とするようになりました.では徴生物では研究することが無くなったのでしょうか。そうではありません。データか出にくくなり、流行の研究対象から外れたと言えます。学問研究の流行にはこのような情けない一面があります,21世紀は脳の時代と言っても、また脳に関して多くのことが分かるでしょうか、現在の技術で到達できるレベルに限界がある筈です。一方、独創的、画期的新技術が誕生すれば微生物でも再び注目の研究対象になり得ます。
新しい研究対象の発見と新技術の開発は研究者に多くの研究テーマを与え、研究における車の両輸と言えます。私の卒業した農芸化学は日本で独自の発展を遂けたユニークな分野ですが、そこでは新しいモノあるいは現象の発見を何よりも評価します。そのためにスクリーニングという地道な作業を重視します,これまでの日本の生命科学研究において、このような努力が農芸化学以外の分野で余りなされず、それか我が国で独創的研究が少ない理由の一つである様に思いますが、これは余りにも手前味噌でしょうか。一方X線解析は手段ですので、結晶学者への期待も技術的なことが第一でしょうか。例えば坂部先生の独創的発明のような。また、シトクロム酸化酵素の様な膜タンパク結晶化のための一般的法則の発見も、この分野に太きな貢献をするでしょう‘しかしながら、結晶構造解明の例を一つ一つ増やしで行くことも勿論、必要な作業です。そして酵素などの反応機構を説明する上で、X線結晶解析は今のところ何よりも有カな手段です。またP450が何故あのようなバイオダイパーシティーを獲得し得たかという問題は、個八的に非常に興味があります。それを考える上で、構造解析の例を一つでも増やすことは重要な作業であり、このような分子進化の課題においても結晶学者は大いに貢献できるでしょう。勿論結晶学者も生物を勉強し、その要点を理解しておく必要がありますが。
物理学や化学は単なる技術では有りませんが、それらの生命科学への進出に関しても技術革新と似た面があります。生命研究では新しい現象を見つけるところから始まり、その現象を物理化学的に説明する、という一つの必然的流れが出来ています。我々生化学者は新しい現象あるいは材料を提供し、皆さんのような物理化学者が理論的に考えるという分業です。近代的分子生物学誕生以来、物理化学的解析の重要性は実は確実に増加しております.X線結晶解析も生命科学における重要手段の一つとなりました,我々生化学者も新しい研究テーマを探す努カを怠ると、徐々に出番が無くなるでしょう。
生命研究の面白さに多くの物理化学者が気付いたのは、やはり最初は米国においてでした。分子生物学や遺伝子工学など、今世紀最大の生命科学新分野の創設には、実はおもに米国の物理や化学出身の科学者が中心となりました。今から20年以上も前のことですが、ある酵素の国際学会に参加し、そこで米国の物理化学の研究者敷の多いのに圧倒されました。日本からは殆どいないのに、です。彼の国では何十年も前から、圧倒的に多数の優秀な物理化学者が生命科学の分野に進出しているのです。今後我が国においても、若い物理化学者の中からそのような創造的研究者が多く出てくれることを願っております。そのためには、物理化学の優秀な学生に生命研究の魅カを伝える必要が有りますか、日本ではそのようなシステムが未だ整っていないように思われます。
参考文献
1. 化学と生物 Vol. 34, No. 1, pp. 4-5 (1996)
2. M. Kobayashi, and H. Shouun: J. Biol. Chem. 271, 16263-16267 (1996)