
はじめに
α−アミラーゼは、澱粉や様々なオリゴ糖のα-1,4グルコシド結合を加水分解する酵素である。この酵素は、工業用酵素として現在最も大量に使われている酵素であり、主に、澱粉からの糖製造において澱粉を最初に液化する工程や、布を織る時に糸の滑りや強度を高める目的で加えられる澱粉糊を除去する工程で大量に使われている。こうした工程で用いられる酵素は、そのほとんどが Bacillus 属由来のものである。これは、微生物由来であるため大量生産に向いていることに加えて、 Bacillus 属由来の酵素が優れた耐熱性を示すことによる。
我々は、 Bacillus 属由来のα−アミラーゼの耐熱性と分子構造との関連性に興味を持ち、中程度の耐熱性を示すB.amyloliquefaciens 由来のα−アミラーゼ(至適温度55-60℃、以下BAAと略す)と高い耐熱性を示すB.lichenifoformis 由来のα−アミラーゼ(至適温度80-85℃、以下BLAと略す)の2つの酵素のX線結晶解析を行い、両者の立体構造の違いから酵素の耐熱性のメカニズムを明らかにしようと考えた。BAAとBLAは共に、アミノ酸残基数483、分子量5,5000であり、アミノ酸配列の同一性も80%と高い。また、両酵素とも活性の発現にはカルシウムイオンが必要である。ここでは、BAAとBLAの2つの酵素の結晶解析の過程と、両者の構造の比較の結果明らかになったBLAの耐熱化の機構について述べる。
実験
BAAとBLAの結晶解析
両酵素の結晶解析は1989年に同時に始められたが、後述するようになかなか良い結晶が得られず、解析が先に進んだBLAについて分子モデルの組み立てが可能な電子密度図が得られたのは、1995年であった。しかしながら、この年にHuberらのグループによってBLAの結晶解析1)が、我々のものとは異なる晶系で行われてしまった。そこで、この年以降は、BAAの解析が主となった。
BAAの解析は、BLAの原子座標が入手できなかったため、我々のグループでMlR法+density modification により得られたBLAの電子密度分布をモデル分子として分子置換法により行った。なお、BLAの解析も我々の晶系のものについて精密化まで行い、BAAとの構造の比較に用いた。
結晶化の長い道のり
BAAの最初の結晶化スクリーニングで得られた結晶は非常に細い針状晶(太さ0.01mm以下)でこれを大きくすることがまず大変だった。しかしながら、蛋白質濃度を偶然0.5%から1%に上げたことにより、針状晶は平行六面体状の外見の結晶に変 わり、サイズの問題は解決された2)。しかしながら、同じような平行六面体状の結晶でも、単斜晶と斜方晶の2つ晶系があることが解った。解析には非対称単位中に含まれる分子数の小さい斜方晶系の結晶を選んだが、外見から見分けることのできない他方の結晶の存在にずっと悩まされた。また、この結晶の成長・保存のためにはリン酸緩衝液が必須で、これがBAAで重原子誘導体が見つからなかった主因と考えられる。
BLAの最初の結晶化スクリーニングでは、薄い板状晶が向きを変えながら多数積層した結晶が得られた。この結晶は、pH、蛋白質濃度、沈殿剤濃度、結晶化温度等の調節では単結晶にならなかった。そこで、結晶母液に種々の添加物質を少量加える実験を行った。その結果、見つかったのがEDTAである。α-アミラーゼは、酵素活性を保つためにカルシウムを必要とするため、カルシウムを酵素から奪い取るEDTAの添加は、分子の立体構造を壊す危険性がある。しかしながら、当時大学院生だった伊藤嘉章氏は、あえてEDTAを添加し、きれいな柱状晶を得ることに成功した2)。
BLAではその後、使用できる重原子化合物の種類を増やすために結晶化PHを中性にする、及び、同型置換法を行うのに十分な精度の回折データを収集できる結晶サイズを確保するため、の計2回にわたり結晶化条件の変更が行われた。これらは、結晶の問題で重原子誘導体の探索が行き詰まったことに気づく度に行われたので、結果として結晶解析が大きく遅れてしまった。両アミラーゼにおいて最終的に結晶解析に用いた結晶の結晶化条件及び結晶学的データを表1に示す。なお、解析の行える結晶が得られるまでに、BAAでは2年の歳月が、そしてBLAでは実に6年の歳月が流れた。
放射光X線を用いた回折強度データの収集
BAA・BLA共、X線回折強度データの収集は、全て高工研放射光施設のBL-6A2ビームラインにおいて蛋白質用ワイセンベルグカメラとイメージングプレートを用いて行った。回折イメージの処理には、プログラムWEISを用いた。BAAのNativeの回折データ、及び、BLAのNativeと3つの重原子誘導体からのデータ収集の結果を表2にまとめる。

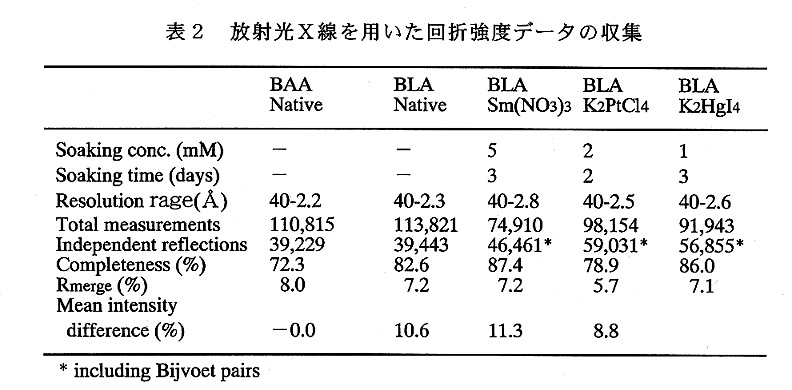
BLAにおいて、Nativeと各誘導体間の回折強度の差は10%前後と小さく、シンクロトロン放射光を使って測定誤差を小さく抑えることが必須であった。
MIR法によるBLAの初期位相の計算
BLAでは、Sm、Pt、Hgの3つの重原子誘導体が得られ、MIR法により位相を計算することができた。重原子パラメーターの精密化と位相の計算には、CCP4のMLPAPEを用いた。3つの重原子誘導体とも異常分散の効果も含めて位相を計算したが、10〜3Å分解能における平均のFigure of meritは0.39であった。得られた電子密度図は、5Å分解能では、分子領域が一目で解る良質のものであったが、3Å分解能では、ノイズが多く、1本のαヘリックスが、かろうじてトレース可能な程度であった。そこで、CCP4のDMを用いて電子密度図の改善を行った。
DMによるBLAの電子密度図の改善
Non-Crystallographic Symmetry averaging(NCS averaging)を効果的に行うためには、1)平均化が行われる範囲=分子領域を正確に決定すること、2)非結晶学的対称(NCS)を記述する回転・並進パラメーターを正確に求めることが必要である。BLAの解析では、1)を行うために分子マスク作成支援プログラムパッケージMASKMAKEが森部により開発された。このプログラムは、シリコングラフイックス社のIRISシリーズ用に開発されたもので、ディスプレイ上に表示された電子密度図を見ながらマウスの操作で分子マスクを容易に作成することができる。(図2参照)BLAの分子マスクは、3Å分解能のMIRマップから作られた。
一方、NCSパラメーターは、まず重原子サイトの位置から荒く求め、これを、5Å分解能のMIRマップにおいてNCSの関係にある分子間の電子密度相関が最大となるように、実空間サーチを使って精密化した。さらに、DMを使って実際にaveragingを事前に何回も行いながら精密化し、その結果、収束した値が正確なNCSパラメーターであるとして、DMの本番で使用した。
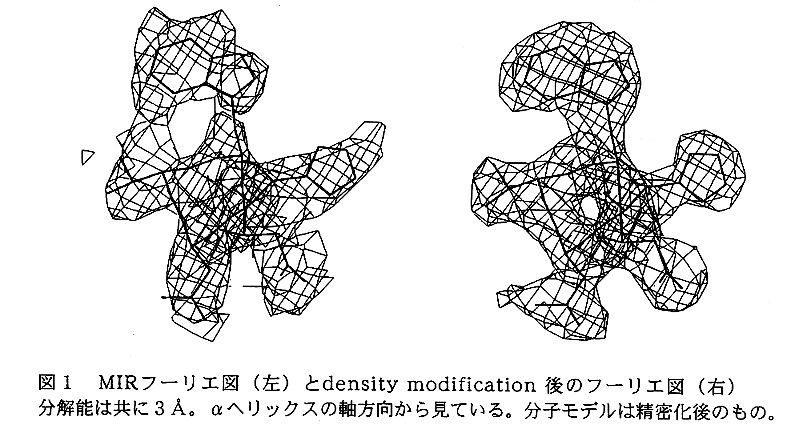
DMによる実際のdensity modificationでは、NCS averaging に solvent flattening と histogram matchingを組み合わせて行い、100サイクルのうちに分解能を5から3Åに上げた。こうして得られた3Å分解能の電子密度図は、精密化後に描かれた電子密度図のようにきれいであった。(図1参照)そこで、このBLAの電子密度分布をモデル分子とする分子置換法によりBAAの構造解析を試みた。
DM後の電子密度分布を使った分子置換法によるBAAの解析DM後の3Å分解能の電子密度分布を使ったBAAの分子置換法による解析は、次の手順で行われた。
BAAとBLAの分子モデルの組立・精密化
BAAは分子置換法により、BLAは、MIR法 + density modification lこより共に良質の電子密度図が得られたため、分子モデルの構築は順調に進んだ。どちらの場合も最初の分子モデルの構築は、3Å分解能の電子密度図を用いて行い、実際に組み立て たのは非対称単位中のどちらか1分子のみである。これをNCSパラメーターで変換することにより、もう1つの分子のモデルを得た。分子モデルの構築・修正には、プログラムTURBO-FRODOが用いられた。
分子モデルの精密化は、プログラムX-PLORを用いて simulated annealing の手法で行われた。分解能は、最初に組まれた分子モデルを精密化するときのみ3Åとし、それ以降のステージでは、回折データの得られている上限、BAAは2.3Å、BLAは2.2Åで精密化が進められた。2Fo-FCフーリエ図が不明瞭な部分についてはomit mapを描き分子モデルの再構築を行った。水分子の組み入れは、結晶学的R値が20%を切ってから行われた。最終的なR値は、BAAが、10-2.2Å分解能の反射に対して15.7%、BLAが、10-2.3Åで14.8%であった。
BAAでは、全483残基について構造を明らかにすることができ、また、酵素の構造保持に重要なカルシウムイオンの結合サイトも3カ所同定することができた。その一方で、BLAでは、ポリペプチド鎖のN及びC末端の1〜2残基とカルシウムイオンの結合に関与する残基番号180〜190付近のループの構造が、ディスオーダーのため電子密度図上に現れていなかった。また、カルシウムイオンも結合していなかった。α−アミラーゼでは、カルシウムイオンが、酵素活性に必須であることを考えると、今回得られたBLAの構造は、活性酵素のそれとは若干異なるものと考えられる。なお、Huber らがおこなった別の晶系のBLAの結晶解析1)でも、結晶化の際にEDTAを使っており、両末端の1〜2残基、180〜190付近のループの構造及びカルシウムイオンが見えていない。こう考えると、今回のBAALの構造解析により、Bacillus 属由来の酵素について初めてその「活性な」構造が明らかにされたともいえる。
結果及び考察
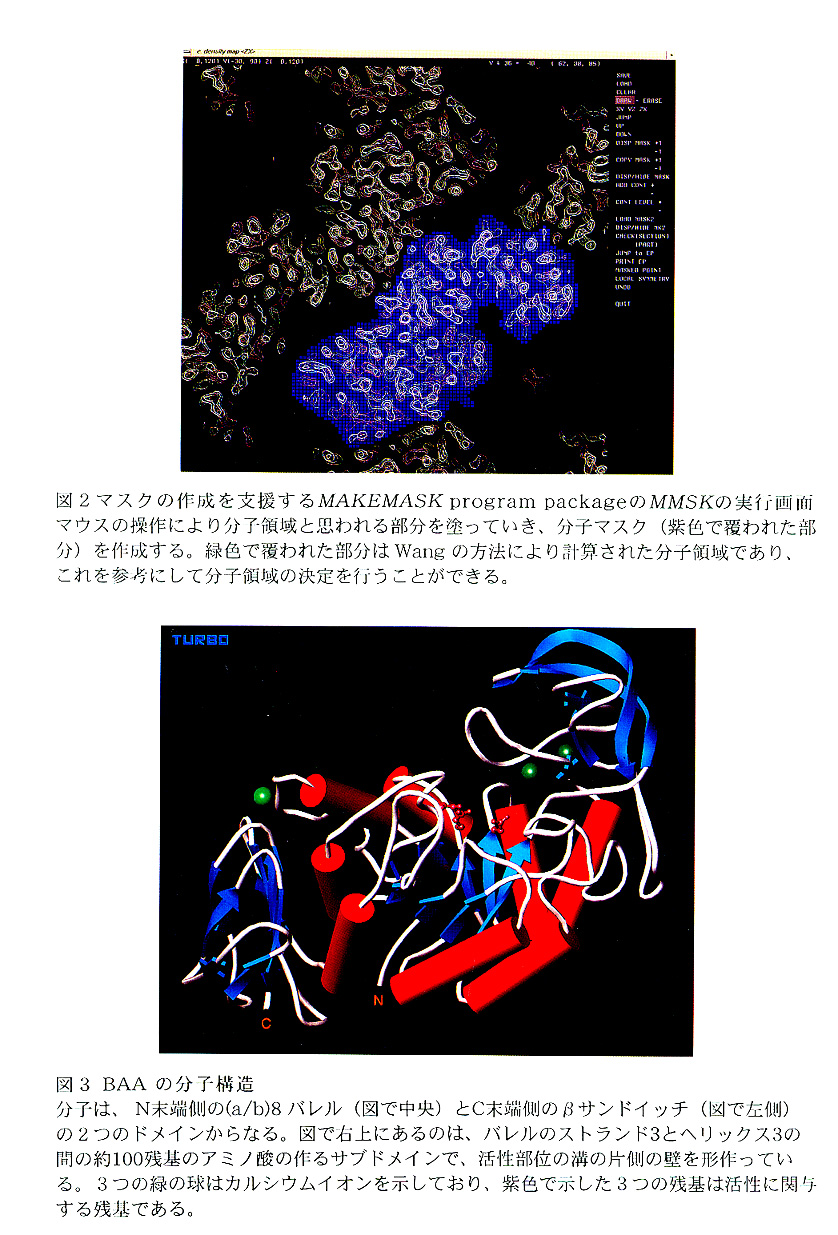
分子全体の構造BAA/BLAとも、分子は、(α/β)8バレル構造をとるN末端側ドメインとβサンドイッチ構造をとるC末端側ドメインの2つのドメインからなる。そして、活性部位は、(α/β)バレルのβストランドのC末端側に形成されている。(図3参照)こうした分子の基本構造は、黄麹菌由来のタカアミラーゼ3)や大麦4)やブタ膵臓由来5)のαアミラーゼとほぼ同一であるが、(α/β)8バレルにおける各αヘリックスの長さや相対位置、ストランド−ヘッリクス間のループの長さや構造は、BAA/BLAとこれらで大きく異なっている。他の由来の酵素と比べたときに、BAA/BLAの構造において目を引く部分は、(α/β)バレルのβストランド3とαヘリックス3の間に存在する約100残基のアミノ酸からなる構造である。この部分は、活性部位のある溝の片側の壁を形成するが、BAA/BLAではこの部分が他のアミラーゼに比べて特に大きく発達しており、1つのサブドメインを形成している。
カルシウム結合部位
結晶解析の結果、BAAでは、結晶中で分子1つ当たり3つのカルシウムイオンが結合していることが解った。この一方で、今回解析したBLAでは、結晶化にEDTAを用いたためカルシウムイオンの結合は見られなかった。
BAAにおいて、カルシウムイオンは、N末端側ドメインとC末端側ドメインの間に1つと、活性部位の片側の壁を形成するサブドメインの中に2つ結合しており、酵素の立体構造保持に使われている。(図3参照)このうち、特にサブドメイン中の2つは重要であり、これらの無いBlAでは、これらにより支えられていたと考えられる11残基よりなるループ構造が、電子密度図上に現れておらず、カルシウムが無いことによりデイスオーダーになっていることが明らかになった。
BAAとBLAの構造の比較による酵素耐熱化機構の検討
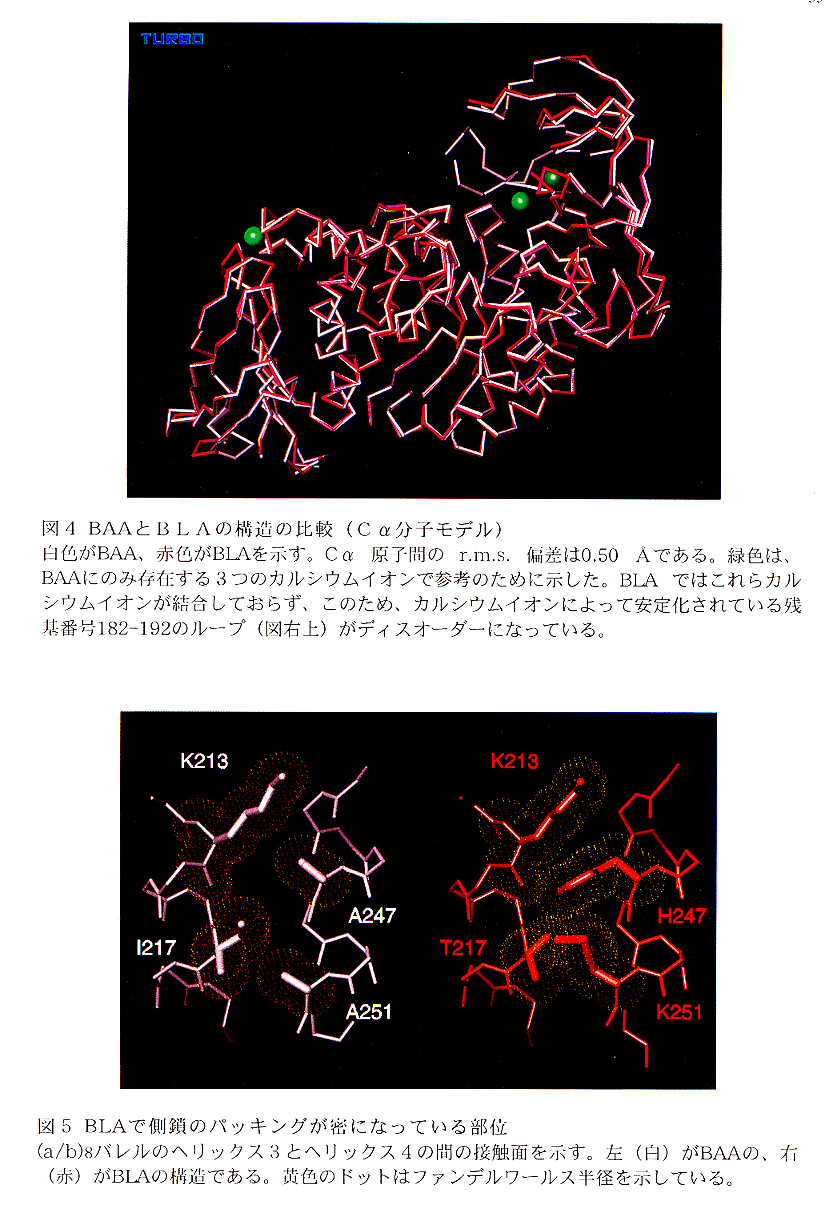
BAAとBLAの至適温度の違いは約25℃ある。また、90℃に保った場合、BLAはBAAに比べ約100倍長寿命である。こうした両酵素の耐熱性の違いは、立体構造に反映されているものと考えられる。そこで、両酵素の構造を比較することにより、BLAの耐熱性の機構を調べた。両者の主鎖構造は、全Cα原子のr.m.s.偏差が0.50Åと良い一致を示す。(図4参照)そこで、両者の間でアミノ酸置換の起こっている分子全体の20%に相当する94残基について、側鎖の相互作用の違いを調べた。これらのうちの約2/3は、分子表面に位置し、分子内相互作用に関与していない。残りの約1/3(30残基)が、分子内相互作用に関与しており、従ってBLAとBAAで相互作用に何らかの差が現れている部位である。
これらの部位で、水素結合の数の増減を調べてみると、BAA一>BLAの変化により、側鎖一側鎖間又は側鎖一主鎖間の分子内水素結合の数が、5増加し2減少している。このように耐熱化に伴う水素結合の数の増加はそれほど大きくなかった。
一方、疎水性相互作用に目を向けると、BAA一>BLAの変化により、分子内部において親水性アミノ酸が疎水性アミノ酸に換わったところが無く、BLAにおいて新たに疎水性相互作用が生じた部位は無かった。ただし、疎水性アミノ酸が別の疎水性アミノ酸に置き換わることにより、疎水性側鎖同士の接触面積が明らかに増加している部位が2カ所ほど見つかっている。
なお、BAA->BLAの変化により、新たにソルトブリッジはできていない。また、S-S結合の導入やプロリン残基の導入により、主鎖のコンフオメーションに束縛を与えるような変化も起こっていなかった。
BAAとBLAの構造を比較したとき、両者のアミノ酸残基の違いによる差が最もはっきりとしていたのは、分子内部での側鎖のパッキングであった。すなわち、BLAのほうが、側鎖のパッキングが巧みであり、分子内部に隙間ができ難くなっている。この最も顕著な例が、(α/β)バレルドメインにおいて3番目と4番目のαヘリックスが互いに接している部分である。(図5参照)この部分では、BAAの247番及び251番のアラニンがBLAでは、ヒスチジンとリジンになっている。これにより、水素結合や疎水性の相互作用の大幅な増加は見られないが、αヘリックス間の隙間が埋まり、ヘリックス同士がジッパーで留められたようにしっかり結びついている。
BLAの耐熱化のメカニズムを分子内相互作用の点からこのように調べてみると、BAA->BLAの変化にともなう水素結合や疎水性相互作用の増加、及び、分子内部での側鎖のパッキングの最適化などの小さな変化が積み重なって、酵素全体の構造を大きく変えることなく熱安定性を向上させている様子が浮かび上がってきたように思う。
おわりに
ようやくBAAとBLAの構造解析に一段落がつき、現在、今後の研究の展開を考えているところである。幸い今回解析を行ったBAA-BlmA両結晶とも、活性部位が結晶格子内でのパッキングによりふさがれていない。したがって、まず、基質アナログ等を結晶中に導入してその相互作用を調べようと思っている。また、ラウエ法による酵素反応の動的解析にもトライしたいと思っている。
最後となりましたが、この研究を始めるにあたり試料の提供及び様々な助言を頂いた名古屋大学農学部の鵜高重三教授(現名誉教授)、結晶構造解析を進めるにあたり貴重な助言を頂いた名古屋大学工学部の芦田玉一教授(現名誉教授)、山根隆教授、放射光実験を行うにあたり大変お世話になりました坂部知平教授(現筑波大学)、中川敦史博士(現北海道大学)、渡邉信久博士に感謝致します。また、この研究は、名古屋大学工学部の旧応用化学第4講座、現生物機能工学第2講座を卒業した藤原英樹、伊藤嘉章、西尾寿浩、星井知恵子、各務幾子、鈴木潤平、高橋誠治、沼田夏美、各氏との共同研究であり、実際に実験を行った彼ら彼女らの貴重な努力の結果成し遂げられたことを記し感謝を示したいと思います。
参考文献(解析の手法、装置、プログラムに関する文献は割愛させて頂きました)