1. はじめに
生物は、0℃以下の氷の中から、100℃以上の熱水中まで、地球上の様々な温 度環境の下で生息している。それらの生命活動を維持するために、それぞれの蛋白質 は生育温度の範囲で安定に機能できるように設計されている。蛋白質の熱安定性を決 定づける要因を探し出すために、常温菌と好熱菌の蛋白質の構造比較がこれまでに頻 繁になされてきた。その結果、いくつかの蛋白質耐熱化因子が提案されている。さら に、部位特異的変異や熱力学的の手法を用いることによって、これらの耐熱化因子の 効果が、いくつかの蛋白質の系で確認・定量化されつつある。現在では、これらの知 見に基づいて、熱安定な蛋白質を新たに作り出す試みがなされている。しかし、目的 通りの蛋白質を得ることは今だに難しいのが現状である。この問題を解決するために は、生物が行っている耐熱化方法を、もう一度見直す必要があろう。これまでの蛋白 質耐熱化の研究では、より効果的な耐熱化因子を導き出すために、より高温で生息す る生物の蛋白質をターゲットとしていた。しかし、100℃以上で生育する超好熱菌で さえ、これまでに指摘されている耐熱化因子を利用していることが、最近の研究によ り明らかになってきた(Yipら、1995;Hennigら、1995;Macedo-Ribeiroら、1996)。 このことは、新たに耐熱化因子を探さなくても十分に蛋白質を耐熱化できることを示 唆している。つまり、これまでとは異なる新たな視点からのアプローチが必要である。 生物は様々な温度で生息しており、それぞれの生育温度に対応した方法(以下これを 戦略と呼ぶ)で白己の蛋白質を安定化しているはずである。この戦略を明らかにする ためには、非常に高温で安定な蛋白質だけでなく、別の耐熱化レベルを持つ蛋白質と 調べる必要がある。そこで、これまでにあまり注目されてこなかった中等度好熱菌の 蛋白質に着目した。中等度好熱菌の蛋白質の立体構造を高度好熱菌のものと比較する ことによって、高度の中等度の耐熱化の違いを明らかにすることができる。これlこよ って、蛋白質を様々な温度環境へ適応させるための、より効果的な方法を導くことも できよう。本研究では、3-イソプロピルリンゴ酸脱水素酵素(IPMDH)を夕一ゲット とし、中等度好熱菌 Bacillus coagulans 由来の本酵素(BcIPMDH)のX線結晶構造解析を行った。
2.実験・構造決定
酵素の調製・結晶化
本酵素の遺伝子はクローニングされており、大腸菌での発現が可能である。 BcIPMDHを大量発現した菌を超音波破砕し、63℃の熱処理とポリエチレングリコー ル分画の後、3種類のカラムクロマトグラフィー(Q-sepharose、Hydroxylapatite、 Phenyl-5PW)によって結晶化用の蛋白質溶液を得た。
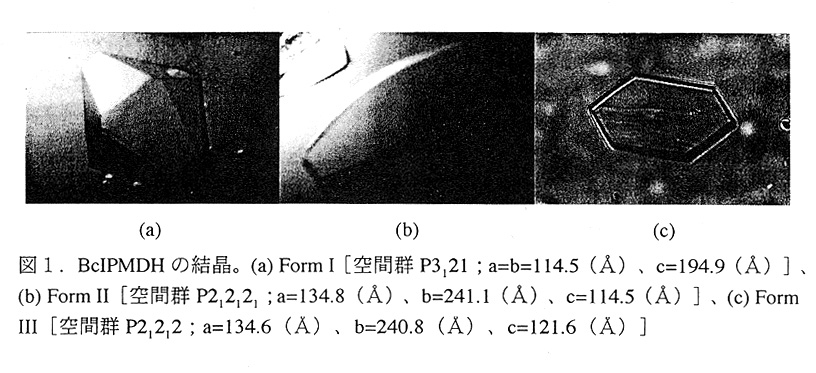
結晶化はハンギングドロップ蒸気拡散法で行った。硫酸アンモニウムとポリ エチレングリコールを沈澱剤として結晶化条件を検索した結果、異なる3種類の結晶 を得ることに成功した(図1)。結晶の密度測定の結果、Form I の非対称単位には二 量体分子1個(2サブユニット)を含んでいることがわかった。VM(=4.6)がMatthews により報告されている値に比べて著しく高い。このように溶媒含量の高い結晶は glycolate oxldase(VM=5.0;Lindqvistら、1980)やkallikrein A と trypsininhibitorの複合 体(VM=4.5;Chenら、1983)など、これまでにいくつか見い出されており、1968年 にMatthewsが提案したVMの範囲を見直す必要があるだろう。

構造決定
Form Iが3つの結晶の中で最も高い回折能(〜3Å)を示したので、この結 晶構造の決定を試みた。X線回折データの収集は、高エネルギー物理学研究所放射光 、 実験施設の巨大分子用ワイセンベルグカメラを用いて行った。回折データの指数づけ および積分はプログラムWlEIS、スケーリングはCCP4のプログラム(SCALAおよび AGROVATA)を用いてそれぞれ行った。その結果、分解能3Åまでで収率85%、Rmergeが5.4%のデータを得ることができた。
初期位相の推定は、分子置換法で行った。高度好熱菌 Thermus thermophilus 由 来の本酵素(TtIPMDH)の結晶構造(Imadaら、1991)からポリアラニンの二量体を 作成し、参照分子として適用した。プログラムAMoReを用いて回転関数と並進関数 の計算を行い、分子の方位と位置を決定した。さらに、Romitプロファイル法で解の妥 当性を確認した。Romitプロファイル法は、一部の構造を削除した参照分子から計算さ れたR値(Romit)を利用して分子置換法の解の妥当性を検証する方法で、著者らが提 案・開発したものである。従来利用されているR値とは異なり、この方法では参照分 子の構造の「部分的正しさ」から解を判定しているので、1つの解の中に含まれる部 分的違いを示すことができた。さらに、本方法により得られた情報は、この後の構造 構築を行う上で参考となった。
得られた初期位相を利用して電子密度を計算し、BcIPMDHの結晶構造を構築 した。前述のようにForm I 結晶は溶媒含量が739%と非常に多く、また、非結晶学的二 回対称があるので、溶媒領域平滑化、非結晶学的二回対称による平均化ならびにヒス トグラム・マッチング法を利用した電子密度の改良をプログラムDWを用いて行った。 構造の原子パラメーターの精密化には、プログラムX-PLORを用いた。この精密化の 初期段階では非結晶学的対称による制約を課し、最後にはこの制約を外して行った。 構造の精密化と部分修正を繰り返し行った結果、最終的に分解能10-3.0ÅでR値 18.0%、R freeが24.7%の結晶構造を得ることができた。
3. 分子構造
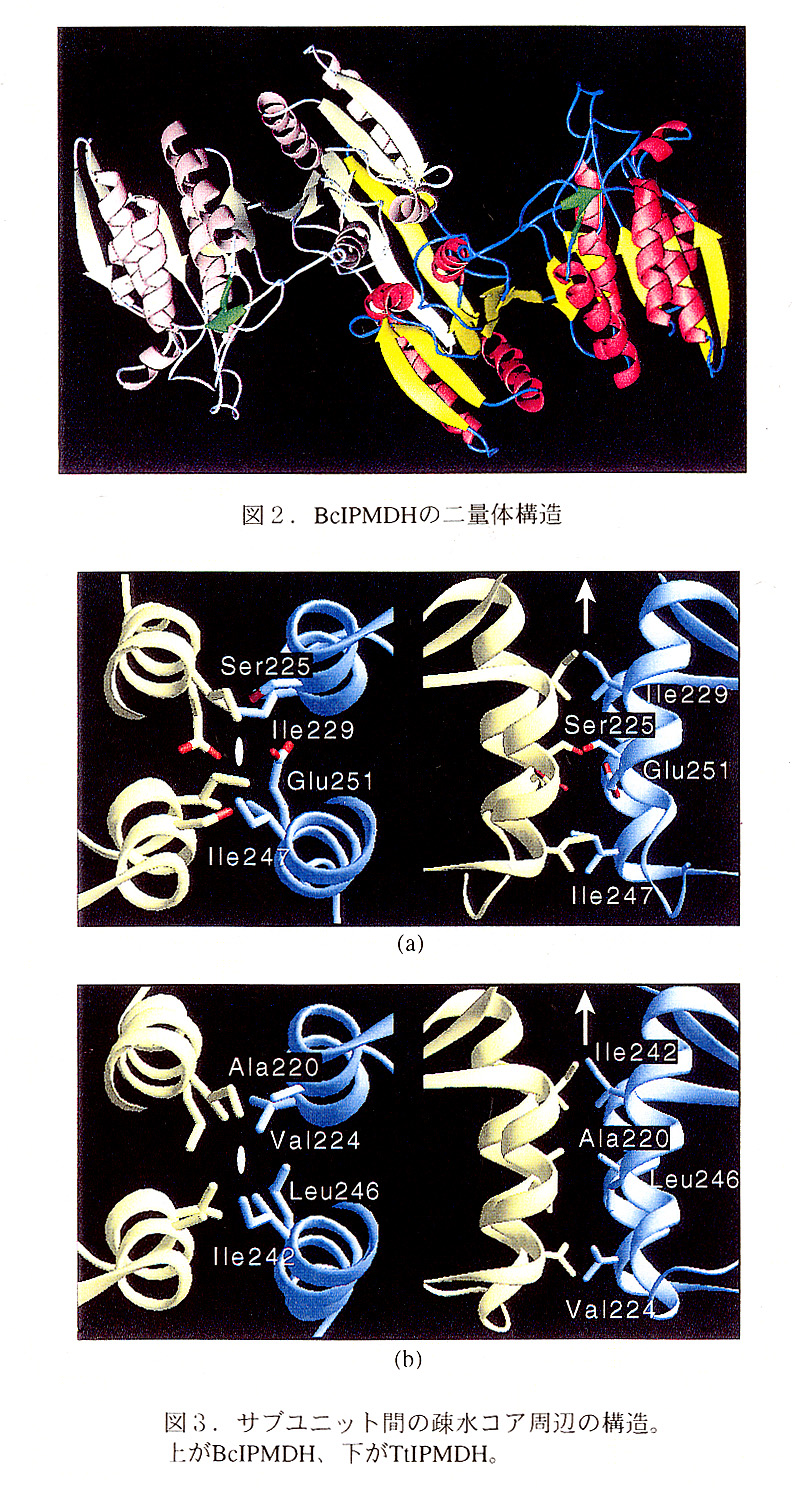
BcIPMDHは、分子量39808、アミノ酸残基数366のサブユニット2つからな る二量体分子である。全体構造を図2に示す。各サブユニットは11本のαヘリック スと14本のβストランドからなるopenα/β構造をとっている。この構造をTtIPMDH と比較すると、対応するCα原子どうしの重ね合せのrms deviationが1.3Åと全体的に は類似している。しかし、分子表面にあるいくつかのループ部分では、両者の構造が 著しく異なっていた。特に、緑色で示してある短いβシートはTtIPMDHにはない二 次構造である。
4. 考察
熱安定性と耐熱化因子
前節で示したようにBcIPMDHとTtIPMDHの構造には大きな違いがないにも かかわらず、熱安定性は大きく異なる。この原因を探るために、まず、これまでに指 摘されている耐熱化因子の面から2つの蛋白質構造を比較した。
、 Matthewsら(1987)は、Xaa→Pro又はGly→Xaa(Xaaは任意のアミノ酸残基)
の置換によって変性状態のエントロピーが減少し、分子全体の耐熱性を向上させうる ことを指摘した。Pro残基はTtIPMDH(25個)がBcIPMDH(18個)より多いので、 この違いが異なる耐熱性の原因の一つと考えられる。すなわち、このPro残基数の違 いは、両者の耐熱性の関係と一致する方向性の変化といえる。一方、Gly残基数にお いてもTtIPMDH(36個)の方がBcIPMDH(31個)より多くなっているが、この変化 は変性状態のエントロピー増大を招くので、両者の耐熱性の関係とは一見矛盾する方 向性の変化である。
ion-pairdngと水素結合は構造のエンタルピーに影響を及ぼし、これらが多いほ ど分子全体の熱安定性は増大する。蛋白質内部に埋もれたion-pairや水素結合の数で は2つの蛋白質に大きな違いはなかったが、分子表面では両者ともに顕著な違いが見 い出された(表1)。正負の電荷をもつ2つの原子間の静電相互作用により形成され るion-pairはTtIPMDHの方が多く、この変化は2つのIPMDHの耐熱性の方向と一致 する。一方、極性原子間の結合距離と角度を考慮して数えた水素結合数はBcIPMDH の方が多く、耐熱性の関係とは一見矛盾する方向性の変化を示していた。

αヘリツクスの末端は二次構造を作る水素結合がないために、この部分に水 素結合を導入することによって二次構造を安定化し、ひいては分子全体の耐熱性を増 加させることができると報告されている(Serranoら、1989)。これは"helix capping" と呼ばれ、Nicholsonら(1988)は、厳密な水素結合ではなくても、helix dipoleと相補 的な荷電アミノ酸残基を導入するだけでも耐熱性は向上すると主張している。この helix cappingは双方のIPMDHでも見られるが、BcIPMDH(16個)の方がTtIPMDH(12 個)より安定化されているヘリックス末端が多い。この変化は、2つの蛋白質の耐熱 性の関係とは見かけ上矛盾している。
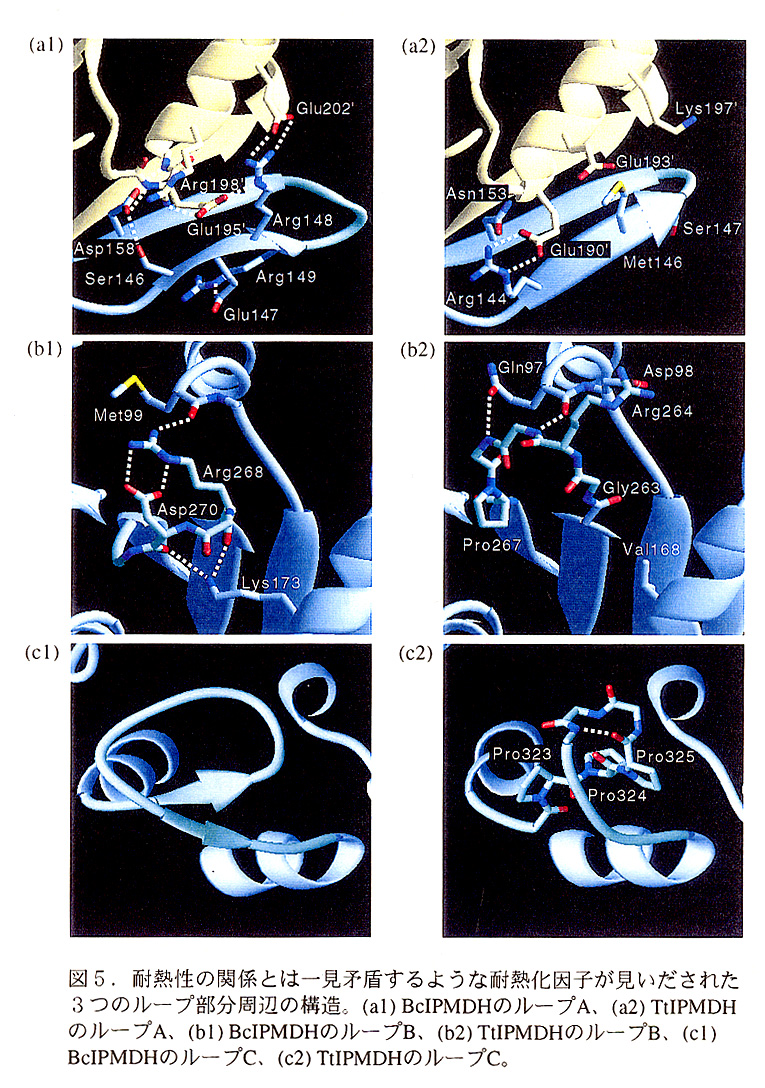
蛋白質内部の疎水コアにある水素結合していない極性アミノ酸は、分子の熱 安定性を著しく低下させる(Blaberら、1993)。図3に示すように、TtIPMDHのサブ ユニット間の接触部位に疎水コアがある。BcIPMDHのこれに相当する部分では、疎 、 水性アミノ酸が水素結合していないGlu残基とSer残基に置換されているので、これ らがBcIPMDHの耐熱性を低下させる原因の一つであると推測される。この疎水コア 内にあるアミノ酸置換の耐熱性への影響は既にImadaら(1991)が指摘しており、Kirino ら(1994)による変異体の研究からも支持されている。
Kellisら(1988)は、分子内部にある大きな疎水性側鎖を小さなものに置換す ると分子全体の耐熱性が減少することから、この「隙間」が蛋白質熱安定性の一つの 指標となりうることを提案している。この「隙間」はBcIPMDH(4.4×102Å3)の方 がTtIPMDH(7.1×102Å3)より小さく、この変化は耐熱性の関係とは矛盾する方向を示している。
さらに、ほかの耐熱化因子についても調べたが、2つのIPMDHの間で顕著な 違いは見られなかった。
2つの耐熱化戦略
表2は、BcIPMDHとTtIPMDHの構造の違いから、分子の熱安定性に奇与す ると考えられる耐熱化因子をまとめたものである。これらの中で、プロリン残基数の 増加と分子内疎水コアの増強は、TtIPMDHの高度な熱安定性に大きく寄与していると 考えられる。一方、耐熱性の関係とは一見矛盾するような構造変化(耐熱化因子)も いくつか見い出された。しかし、BcIPMDHは中等度好熱菌の蛋白質なので、中等度 の熱安定化のために何らかの耐熱化因子を持っているはずである。そこで、これらの 「矛盾点」はBcIPMDHの別の耐熱化方法を示唆しているのではないかと考え、2つ の構造をもう一度見直した。その結果、分子表面にある3つのループ部分(ループA: 150-154、ループB:268-272、ループC:327-343;いずれもBcIPMDHの残基番号) 周辺にこれらの矛盾点が極在していることを見い出した。これらのループ部分は分子 表面にあり、2つの蛋白質で構造が局部的に大きく異なっていた。さらに、酵素の活 性部位から離れているので、これらの局部的な構造変化が酵素の機能には大きく影響 しないと考えられる。以下に、生育温度の異なる2つの好熱菌がIPMDHを耐熱化す るために、どのように耐熱化因子の使い分けているのかを議論する。

ところで、BcIPMDHの中等度の熱安定性を議論するためには、BcIPMDHよ りさらに耐熱性の低い酵素を比較に加える必要がある。そこで、ここからは、常温菌 Bacillus subtilis のIPMDHを比較に加える。この分子の立体構造は今だに解かれていな いが、BcIPMDHとの一次構造上の相同性が高い(図4)ので、BsIPMDHの一次構造 とBcIPMDHの三次構造からBsIPMDHの立体構造を推測することが可能であると考 えた。

BcIPMDHのループBは5残基からなり、2つのβストランドを繋ぐ位置にあ る。先に指摘した矛盾点として、BcIPMDHのこの部分にはTtIPMDHより多くの水素 結合がある(図5-b1)。また、水素結合又は塩橋をしている3つの残基(Lys172、Arg268、 Asp270)は全てBsIPMDHでは保存されていないため、BsIPMDHに図5-b1のような 相互作用は不可能である。したがって、同一構造を仮定して水素結合をカウントすれ ば、BcIPMDHの方が多くなるので、分子表面にあるこれらの相互作用がBcIPMDHの 中等度の熱安定性に奇与していると推定される。一般に、分子表面の水素結合や塩橋 は熱安定性への効果が小さいとされているが(Matthews、1991)、逆に、わずかに安 定性を向上させる中等度の熱安定化のための耐熱化因子であるということもできよ う。一方、さらに安定なTtIPMDHのこの部分(図5-bZ)には別の耐熱化因子がある。 まず、このループ部分のアミノ酸残基の長さが1残基分短くなっている。ループ部分 のアミノ酸残基が短くなると変性状態のエントロピーが小さくなるので、熱安定性に とっては有利な変化である。また、長くて柔軟なループは蛋白質変性において最初に 構造が変化するところなので、短いループのほうが変性の開始を防ぐ効果があるとい う報告もある(Russellら、1994;Macedo-Rmbeiroら、1996)。もう一つのTtIPMDHの 耐熱化因子として、他のIPMDHにはないPro残基がβストランドの付け根の部分に 導入されている。この変化は、先ほど述べたように、ループの柔軟性を制約するもの で、TtIPMDHの高度な耐熱性に大きく貢献すると考えられる。したがって、BcIPMDH のループBは、TtIPMDHではなぐなっていたループの長さと柔軟性を持っており、 中等度の熱安定化のために水素結合を利用していると解釈できる。ところで、 TtIPMDHではループが短くなったことや、新たなPro残基の導入により、263番の主 鎖がGly特有の二面角[(φ,ψ)=(176,-141)]をとらざるをえなくなる。しかし、ここは Glyへ置換されており、起こりうる立体障害を回避していることがわかった。
ループAは、サブユニット間でβシートを形成するために必要な2本のβス トランドを接続している。このループA周辺部分でも、ループB周辺で見られたよう な耐熱化因子の使い分けを見ることができる。まず、ループBと同様に、ここでも BcIPMDHのほうがTtIPMDHより水素結合が多くなっている(図5-al)。BcIPMDH のループA周辺で水素結合または塩橋を形成している残基の中で、Glu147とArg149 はBsIPMDHでは保存されていない。したがって、2つの残基の間の塩橋はBsIPMDH には不可能であり、BcIPMDHの中等度の熱安定性に効果があると推測される。一方、 TtIPMDHでは、ループBと同様に、水素結合が少なくなったかわりにループの短縮 という戦略を適用している(図5-a2)。このループの短縮はBsIPMDHからBcIPMDH への変化でも部分的に見ることができる。また、BcIPMDHのループAには、Proが1 つ導入されており、さらに、主鎖の立体障害を回避するためのGly(151番)がある。 したがって、中等度好熱菌のIPMDHのループA付近では、水素結合による構造の補 強のほかに、高度好熱菌のIPMDHのループBで見られたループの短縮とプロリンの 導入による安定化方法が部分的に利用されている。一方、TtIPMDHでは、主にループ の長さを短縮することで対処している。
BcIPMDHのループCは、TtIPMDHにはない短いβシートのある部分である (図5-cl)。上に述べた2つのループ周辺と同様に、この二次構造のために中等度に 安定なBcIPMDHの水素結合が多くなっている。BsIPMDHのこの部分が同様の二次構 造を形成しているかどうかはわからない。しかし、この部分の一次構造の類似性が極 端に低いので、BsIPMDHが同様の二次構造を持つどうかを今後の解析で明らかにす る必要があろう。一方、高度に安定なTtIPMDHでは、5残基分のループの短縮と、 3つの連続したPro残基の導入によってより高い安定化を実現していると考えられる (図5-c2)。さらに、TtIPMDHのこの部分でも、起こりうる立体障害を回避するため のGly残基が3つ導入されている。
ここに示したBcIPMDHとBsIPMDHの3つのループ部分は、機能をもった蛋 白質構造を保持するためには「不必要なループの長さ」と、Pro残基で束縛しても機 能に影響をおよぼさないような「過剰な柔軟性」を持っていることがわかった。 BcIPMDHは、水素結合や塩橋を利用した構造の補強により、これらの部分を安定化 していた。これは、主にエンタルピー効果で蛋白質を熱安定化する方法である。分子 表面にあるこれらの相互作用は熱安定性に大きな効果がないといわれているが (Matthews、1991)、逆に、中等度の熱安定化のためには適当な方法であると考えら れる。一方、高度に安定なTtIPMDHでは、「不必要なループの長さ」と「過剰な柔 軟性」を削減する方法を主に採用していた。これらは、いずれも変性状態のエントロ ピーに影響を与え、蛋白質の耐熱性を向上させることができる。また、これらの長さ や柔軟性は、削られても機能には影響しないという意味で、「構造的な冗長性」と呼 ぶことができる。さらに、TtIPMDHが冗長性を削減するにあたり、主鎖に立体障害が 生じる可能性のある場合には、Glyの導入でこれを回避していた。
以上の結果から、2種類の細菌が周囲の熱環境に応じて異なる2つの蛋白質 耐熱化戦略を使い分けていることがわかった。まず、耐熱化因子を導入するターゲッ トとなっていたのは、冗長なループ部分である。耐熱化因子の使い分け方は、耐熱化 のレベルに応じて2通りあった。中等度の熱安定化では、エンタルピー的戦略である 水素結合や塩橋による「構造の補強」が有効である。もし、この補強で蛋白質を十分 に安定な状態で保持できなくなると、ループを短縮やPro残基の導入といった「構造 的冗長性の削減」が必要となる。これは中等度の方法とは異なり、エントロピー的戦 略である。今後は、本酵素を用いて戦略の有効性を確認・定量化し、さらに、他の蛋 白質への応用を試みていく予定である。
本研究は1985年頃東京工業大学理学部の笹田義夫教授(当時)、野宗嘉明教 授(現いわき明星大学教授)、関口武司先生(現いわき明星大学教授)、通産省繊維 高分子材料研究所(現物質工学工業技術研究所)の上野勝彦室長との共同研究として 開始した。現在も関口教授とは共同研究を続けている。当初はTtIPMDHのデータを 測定して構造解析を進めていたが、諸般の事情により解析を断念して、はじめに述べ た目的に焦点を絞って中等度の熱安定性をもつBcIPMDHのX線解析に切り替えた。 BcIPMDHも比較的短期間に結晶化することができたが、運悪くそれは非対称単位に 4分子のダイマーを含む結晶であった。その後1分子のダイマーを含む今回の結晶を 得るために数年を費やしてしまった。しかし、苦労の甲斐があって非常に興味ある結 果が得られたことは望外の喜びである。X線回折実験では高エネルギー物理学研究所 の坂部知平教授(当時)、中川敦史博士(現北海道大学助教授)、渡辺信久博士にた いへんお世話になった。ここに改めてお礼申し上げる次第である。
参考文献