
1) はじめに
近年、ものすごい勢いで蛋白質の立体構造情報が蓄積されている。立体構造情 報は、蛋白質の未知の機能の解明に貢献し、さらには分子認識機構の解明により 新たな薬物の開発へと利用されるようになった。一方、酵素を始めとする有用な 分子触媒は、立体構造情報を使うことにより、その機能を自由にコントロールで きるようになったのであろうか?酵素研究の長い歴史にも関わらず、現状はその 機能を改変して自由に扱うことができるとは言いがたいのではなかろうか?
産業用として広く用いられている酵素としては、蛋白質分解酵素や糖加水分解 酵素などがある。このうち、糖加水分解酵素については加水分解生成物のアノ マー構造の違いから"inverting enzyme"と"reatining enzyme"の二つに分類され る(1)。糖加水分解酵素のうち、最も解析の進んだ酵素の一つは、ニワトリ卵白 リゾチーム(HEWL)である。T4ファージ・リゾチーム(T4L)は、糖加水分解酵素 であるが、その加水分解機構については、ほとんど明らかになっていなかった。 活性部位に二つのカルボン酸を含むことから、その加水分解機構は、ニワトリ卵 白リゾチームと類似した機構を有していると考えられてきた(1)。先に我々は、 Thr26をGluへ置換したT4Lの変異体(T26E)が、基質であるペプチドグリカンの 一部を酵素内部に取り込み、失活することを報告した(2)。この立体構造をX線 結晶構造解析により決定し、野生型T4Lの立体構造と比較した結果、新しく導入 したGluの側鎖が、野生型T4Lの同等の位置に存在する水分子(SOL203)を排除し、 代わりに反応して安定な中間体を形成した。この中間体の構造は、半椅子型に歪 んでいた。
この知見は次の二つの問題を提起した。すなわち、Ⅰ)野生型T4Lの立体構造に 、 存在する水分子(SOL203)が、活性に必須な水分子であり、野生型T4Lが、 inverting enzymeであると考えられること。これは、T4Lがニワトリ・リゾチー ムと異なる加水分解機構を有することを意味する。Ⅱ)Gluを別な求核性のアミノ 酸側鎖に置換すれば活性が回復し、人工的に野生型と異なる加水分解機構を作り 出すことができるという可能性である。この二つの疑問を解決するために26位の アミノ酸の変異体を調製し、その加水分解生成物の解析と変異型酵素のX線結晶 構造解析を行った。その結果、予想どおり野生型T4Lは、水分子が糖基質のα側 から攻撃する機構(Single displacement mechanism)を有するアノマー構造非保 持型の酵素であること、および変異型酵素(T26H)は、水分子が糖基質のP側から 攻撃する機構(Double displacement mechanism)を有するアノマー構造保持型の 酵素であることが明らかとなった(3)。これは酵素の加水分解機構を遺伝子工学 的に変換した初めての例である(3,4)。本稿で紹介する研究は、立体構造情報を 元に酵素の活性部位を改変し、触媒機構を変化させた成功例である。
2) 変異体のデザインと調製
まず、共有結合中間体の立体構造(2)を用いて変異体をデザインした。すなわ ち、活性部位に存在するThr-26を他の求核性アミノ酸(Asp、His)や、Glnに 置換した変異体を調製した(表1)。変異体の遺伝子は、部位特異的変異法を用 いて調製し、大腸菌で発現させた。形質転換された大腸菌をLBH培地で培養し 菌体を破砕後、目的蛋白質を可溶化しイオン交換クロマトグラフィーで精製した。 3Lの培養から各々約30mg以上の日的蛋白質を得た。
3) 変異型T4リゾチームの活性と加水分解生成物の解析
変異型リゾチームの溶菌活性は、菌体のペプチドグリカンを塗布したブレート を用いて行った(5)。野生型T4Lは約半日で、T26H変異体では一晩で溶菌による ハローが観測されたが、その他の変異体では3日後もハローが観測されなかった。 得られた結果を表1に示した。

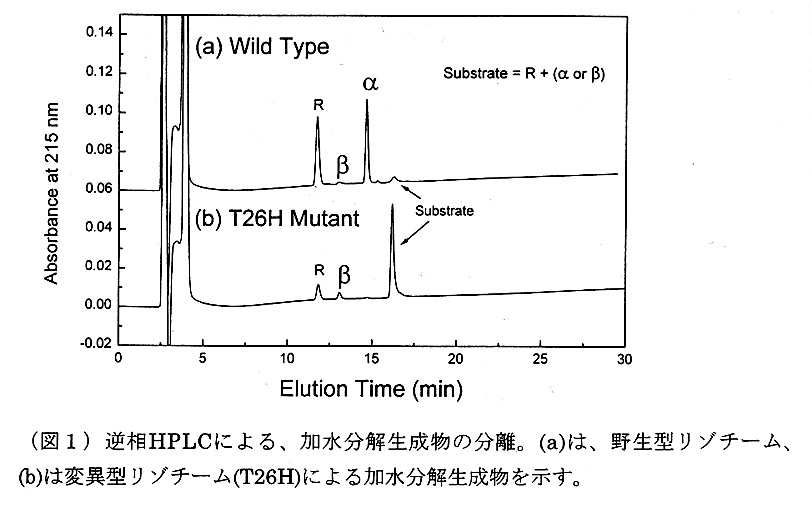
次に、T4Lの加水分解生成物のアノマー型を調べるためにペプチド鎖を有する 糖基質を調製した。その構造は、NAG-NAM-DAla-DGln-diaminopimericacidの 単位構造を有する二量体であり、アノマー構造を同定しやすくするため還元末端 をNaBH4を用いてさらに還元した(4)。この基質を野生型T4LおよびT26H変異 体を用いて25。Cで5分間消化し、逆相HPLCを用いて生成物の解析を行った。 その結果、野生型T4Lはα-アノマーを、T26H変異体はβ-アノマーを生成するこ とを確認した(図1参照)。
4) 変異型T4リゾチームのX線結晶構造解析
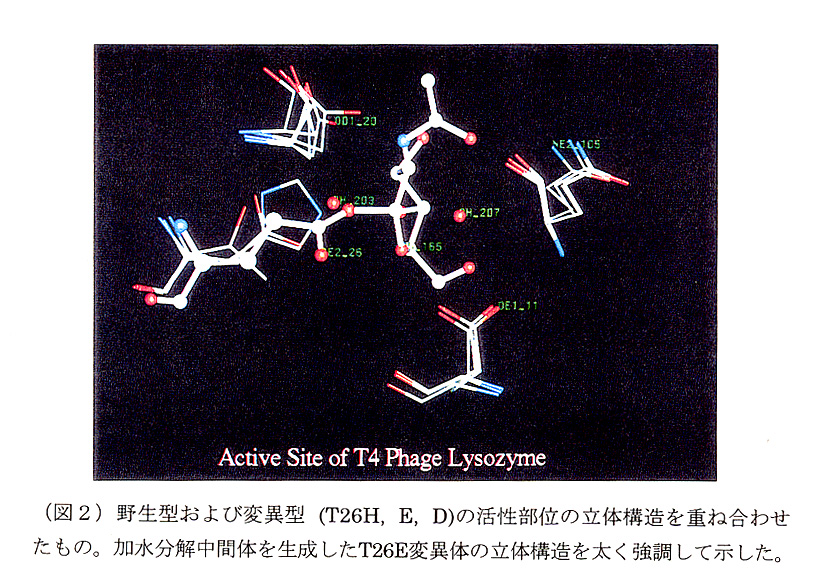
表1に示した変異体を先に報告された条件(6)で結晶化した。結晶は、すべて 野生型のものと結晶学的に同型であった。回折データは、理学電気製RAXlS回 折計を用いて収集し、立体構造の精密化は、TNTプログラムパッケージ(7)を用 い、2.0Å以上の高分解能のデーターを用いて行った。こうして決定された各変異 体の立体構造は、野生型のものとほとんど同じであり、変異した側鎖だけに変化 が見られた。変異体の活性部位の立体構造を図1に示した。野生型T4Lにおいて 存在した水分子(SOL203)は、変異体においては新しく導入されたHis-26のNεあるいは、Gln-26のOE1と置き換わっていることがわかった。
5) 野生型および変異型T4リゾチームの触媒機構
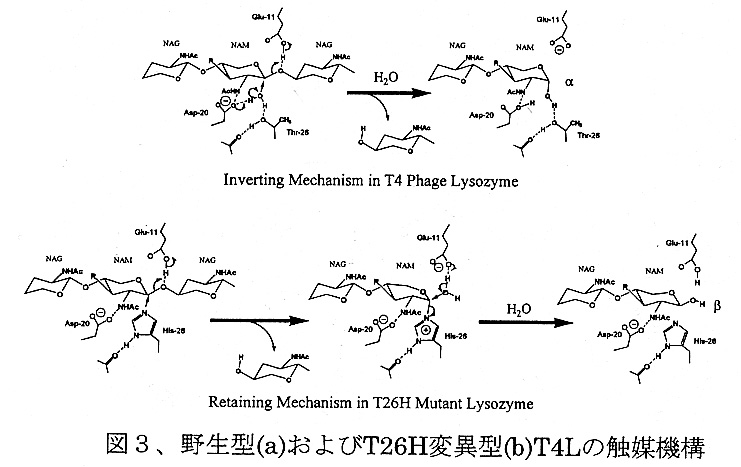
以上の結果を基にした野生型および変異型(T26H)酵素の加水分解触媒メカ ニズムを図3に掲げた。野生型酵素の場合、Glu-11(一般酸触媒)からグリコ シル酸素へプロトンが渡ると同時に、Asp-20(一般塩基触媒)によって活性化 された水分子が、活性部位に結合した歪んだ糖分子のCl原子をα側から攻撃し、 一回の置換反応によって加水分解反応が終了する。このメカニズムは、a)酵素反 応生成物がα-アノマーであること、b)水分子(SOL203)が糖分子のα側に存在し、 この水分子を除去するような変異を施した変異体では、すべて活性が消失したこ とによって強く支持される。
T26H変異型T4Lの場合、反応開始時点でのGlu-11の役割は同じだが、糖 分子は水分子の代わりにヒスチジンの側鎖と一回目の置換反応を生じ、共有結合 中間体を形成すると考えられる。この共有結合中間体は、Glu-11によって活性 化(一般塩基触媒)された水分子との間で生じる2回目の置換反応によって加水 分解され、反応が終了すると考えられる。この機構は、i)酵素反応生成物がp-ア ノマーであること、ii)非求核性側鎖(Gln)を導入した場合には失活し、求核性 側鎖を有するアミノ酸では活性が回復するか(T26H)あるいは基質との反応が 見られる(T26E)こと、およびc)野生型T4Lの立体構造に見られる水分子の位置に は、HisのN6あるいは、GlnのOE1が存在するという事実から強く支持される。
おわりに
T4Lの活性部位近傍に存在するたったの一残基のアミノ酸を改変することによ り、野生型T4ファージ・リゾチームは、水分子が糖基質のα側から攻撃する(Single displacement mechanism)機構を有するアノマー構造非保持型の酵素から水分子 が糖基質のβ側から攻撃する(Double displacement mechanism)機構を有するア ノマー構造保持型の酵素に変換された(4)。これは、遺伝子工学技術と立体構造 解析技術の融合することによって初めて可能となった。
最近、この変異型酵素が糖転移反応を触媒することを発見した。すなわち、こ の種のアミノ酸置換は糖加水分解酵素を糖合成を触媒する酵素へ変換する方法を 与えるものと考えられる。今後は加水分解機構と糖転移活性の相関について研究 を進めていきたい。
本研究は、オレゴン大学分子生物学研究所、Brian W.Matthews教授の研究室 との共同研究の成果である。変異型リゾチームの回折データは、TARA坂部プ ロジェクトを通じて取得した。
文献