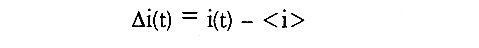
1.はじめに
現在構造解析を進めている蛋白質の粒径分布を、動的光散乱により測定した結果を図1 に示す。典型的なバイモーダル(ピークが2つ)となっている。このまま結晶化に用いた ところ、予備実験で条件がほぼ判っていたにも関わらず、結晶は得られなかった。ところがこの蛋白質溶液を濾過し、変成した蛋白質のアグリゲーションに由来すると思われるピークを除き、モノモーダル(ピークが1つ、即ち粒径が揃っている)にしたところ(図2) 結晶が容易に得られるようになった(図3)。用意した蛋白質溶液が結晶化に適している か否かを判断するのに、動的光散乱が効力を発揮した好例である。
本稿では、動的光散乱の結晶化への応用について述べる。結果を公表できない試料が多 く、具体例に乏しい点はあろうが、結晶化での利用法はご理解いただけると思う。尚、引用した全ての測定は、温度調節付動的光散乱測定装置、DynaPro801-TC(Protein Solutions/リガク)を用いて行った。
2. 動的光散乱の測定原理
動的光散乱は、ブラウン運動、すなわち揺らぎの速さから、粒径を求める方法と言える。この原理を簡単に述べる。測定上の注意点も、自ずと明らかになるためである。
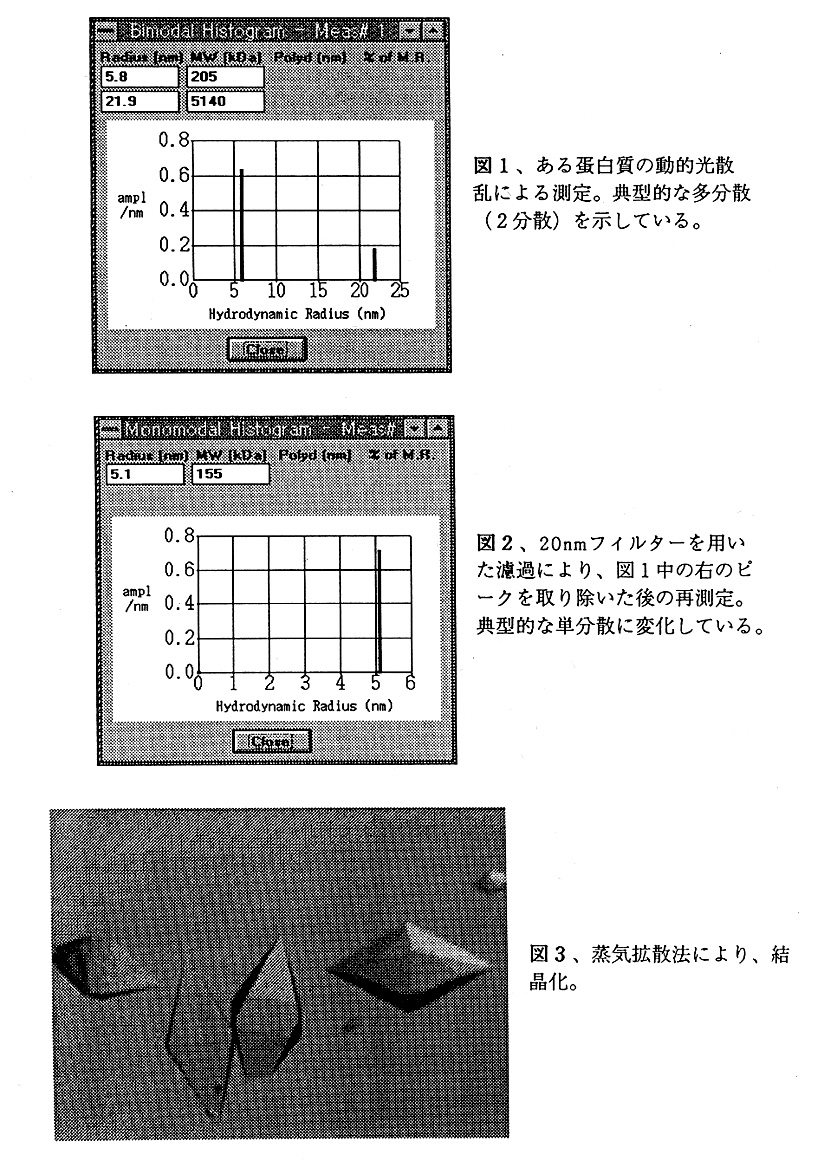
先ず、蛋白質水溶液を考える。蛋白質分子は白由に運動しているものとする。この溶液 中に、ある体積を仮定する(図4)。レーザー光をこの体積に照射し、散乱強度を記録す る。箱の体積が十分大きい場合、幾つかの分子が箱に入ると、ほぼ同数の分子が出ていく ので、全体としての蛋白質分子の出入りは無視できる。従って散乱強度に変化は見られな い。ところが箱を十分小さくしたらどうであろうか。箱が大きい場合には観測されなかっ た、粒子の出入りの僅かな差が相対的に大きくなるため無視できなくなり、散乱強度にば らつき(揺らぎ)が見られるようになる。この揺らぎの速さは、粒子の運動速度を反映し ている。大きく遅く動く粒子を含む溶液では、ゆっくりと揺らぎ、小さく速く動く粒子で は、速く揺らぐ(図5)。従って、強度の揺らぎの速さを測定できれば、粒径に関する情 報が得られると考えられる。強度の揺らぎの速さは、自己相関係数を用いて推定する事が できる。時刻tに於いて光を当て、散乱強度を測定する。散乱強度は、平均値<i>の周り で揺らいでいると考えられるので、揺らぎの成分△iは次のようにあらわせる。
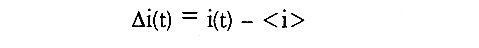
次にτ時間後、すなわち時刻t+τにもう一度光を当て、散乱強度を測定し、平均からのずれ△i(t+τ)を求める。この手続きを何度も繰り返し、△i(t)と△i(t+τ)の積の平均を考える。
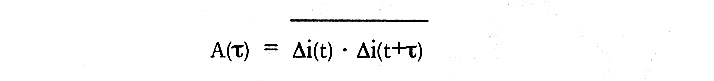
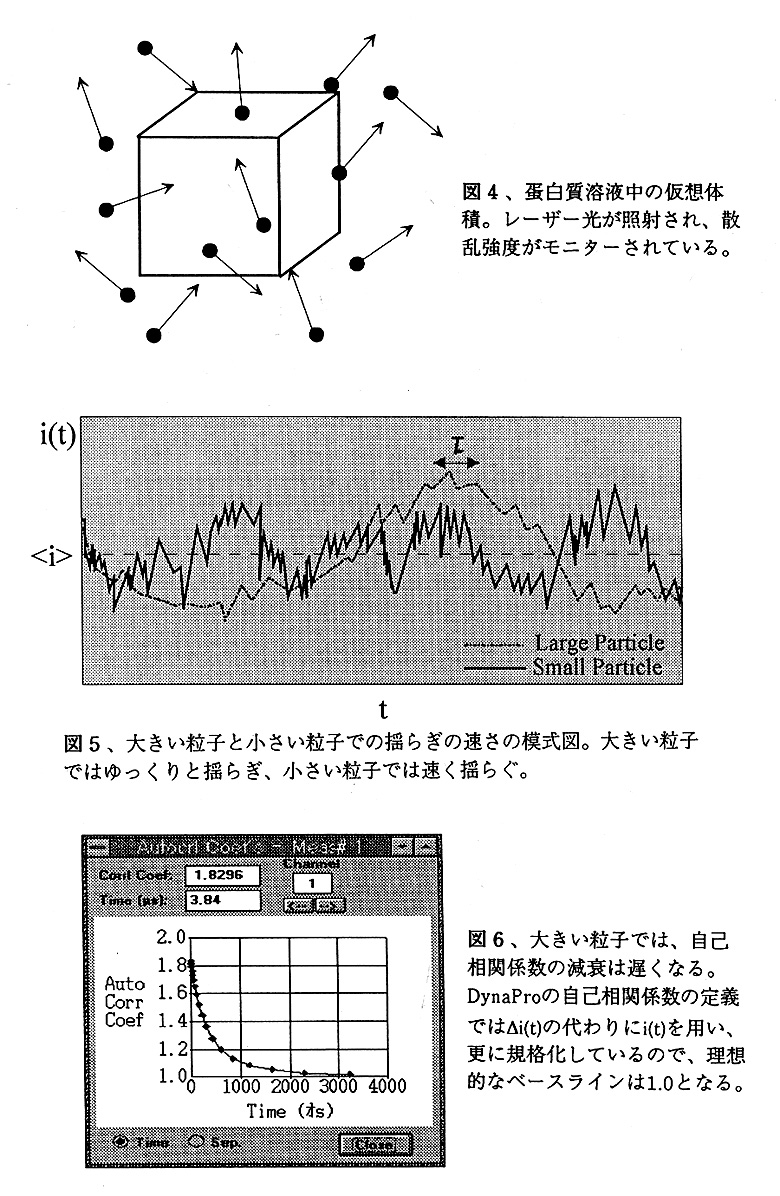
このように定義されたA(τ)は、自己相関係数と呼ばれている。A(τ)の性質を見て行こう。τが揺らぎの速さに比べて非常に大きい場合、△i(t)と△i(t+τ)の間の相関A(τ)はゼロに近づく。△i(t)と△i(t+τ)の符号は、ランダムに異なるためである。逆に11が揺らぎの速さに比べて非常に小さい場合、△i(t)と△i(t+τ)の相関は高く、同じ符号を持つ確率が高くなる。従って積は正となる。τが増加するに従いA(τ)が減衰していく割合は、揺らぎの速さに依存する (図6・7、注:DynaProの自己相関難数の定義では、△i(t)の代わりにi(t)を用い、なおか つ規格化されているので、ベースラインの理想値は1.0となる)。揺らぎが非常にゆっく りな場合は、大きい工に対してもA(τ)は正となる。事実、A(τ)は指数関数的に減衰し、並進拡散係数Dと次式の関係にある事が知られている。
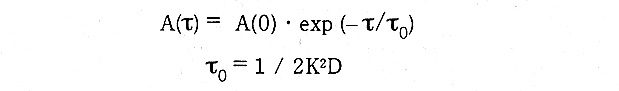
ここでKは、散乱角と波長によって決まる定数である。実測したA(τ)を説明するためには、
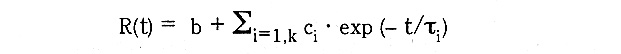
なる関数を仮定し、これを最小二乗法により当てはめる。bはベースライン、c,はゲイン、τは崩壊定数である。理想的な場合、b=0である。モノモーダルではk=1、バイモーダルではk=2となる。崩壊定数が決定されると、並進拡散係数が計算でき、ストークス・アイ ンシュタインの方程式から、それぞれのτiに対し流体力学的半径R,を見積もることができる。
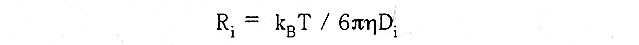
ここで、kBはボルツマン定数、Tは絶対温度、11は溶媒の粘度、Diはそれぞれの粒径に対 応する並進拡散係数である。最小二乗法を用いて最適化するため、フィッティングの良否の程度に関する情報が、標準偏差等として得られる。DynaProでは、先ずモノモーダルを 仮定し、標準偏差の大小やベースラインのずれを確認する。モノモーダルで説明できない場合は、バイモーダルを仮定して計算する。より詳しく分かり易い原理の説明は、成書1)を参照されたい。
3. 粒径分布と結晶化の可能性
動的光散乱で得られる情報は、粒径分布である。動的光散乱が結晶化で有用とされるの は、「結晶化の容易な蛋白質溶液は、粒径がそろっている」という経験則がある為であ る。これを受け入れると、結晶化を始める前に、結晶化の難易をある程度予測できる事になる。また、結晶化に成功していない蛋白質溶液がマルチモーダル(多分散)を示した場 合には、対策の指針を得ることが出来る。モノモーダル(単分散)を示す溶液を目指して、手を加えればよい。論文や経験等を考慮すると、かなり信頼度は高い。これまで相当数の試料を測定してきたが、例外はあるものの、結晶化に成功しているか否かをかなりの確率で予測できている。動的光散乱の結晶化への応用に関する論文は、数多く出されているが2,3,4,5,6,7,8)、Burleyらの結果8)が最も印象的である。彼らは蛋白質とDNAの共結晶に応用し、 結晶化の可能性と粒径分布に、高い相関があることを示した。DNAと蛋白質がしっかり 会合し、粒径分布が狭い溶液のみから結晶が得られたと報告している。
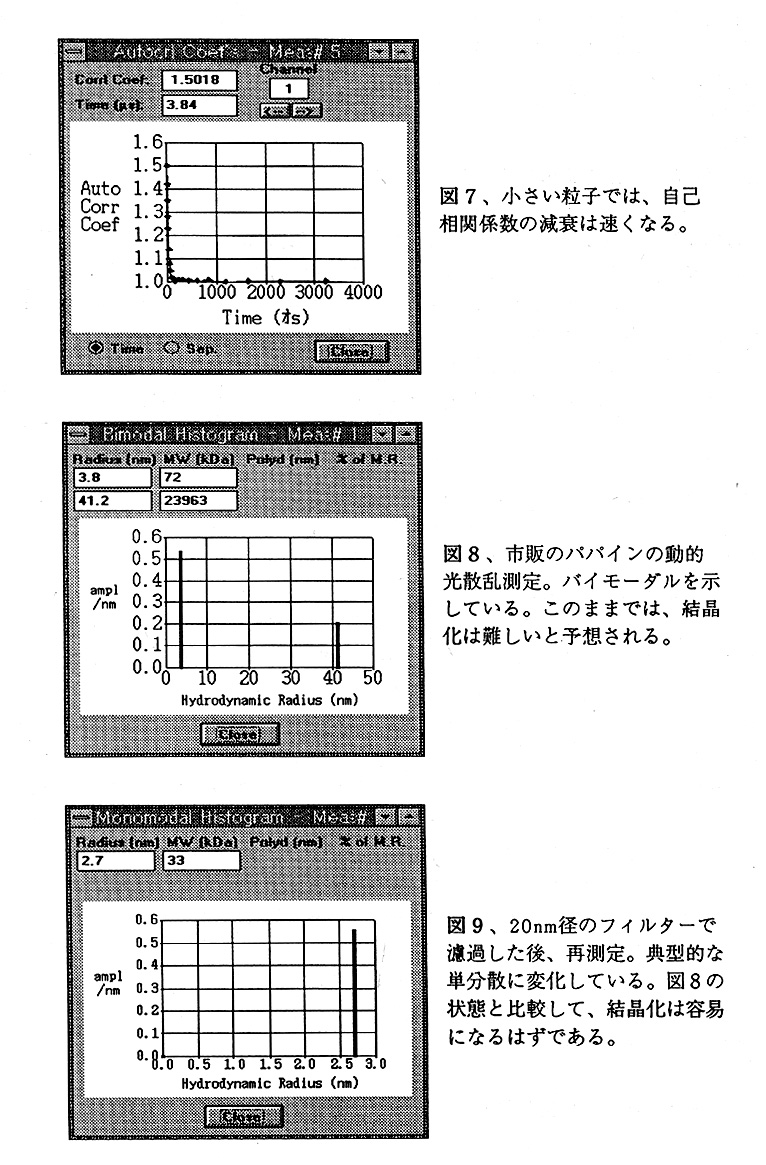
さて、動的光散乱で測定した結果、マルチモーダルが得られてしまったらどうするのか。先ず最初に試みるべき事は、物理的にアグリゲーションを除くことである。図8は、市販 のパパインの測定結果である。0.02μm(20nm)径のフィルターを用いて濾過した後、再 度測定した結果が図9である。バイモーダルからモノモーダルヘ、見事に変化しているの が分かる。市販のパパインはそのままでは結晶化しにくいが、濾過により結晶化し易くなると予想できる。
平衡によって粒径が揃っていない場合は(例えば、モノマー・ダイマー間の平衡)、フ ィルターを通しても意味がない。化学的な方法で、平衡をずらしてやる必要がある。界面活性剤や、表面電化を変化させる物質の投入が必要となるケースである。金属イオンを加えたところ、粒径分布が顕著に狭くなった例もある。
温度変化に敏感な例もある。この様な場合は、異なる温度で測定することにより、結晶 化に最適な温度の目安を得ることもできよう。温度調節付きのDynaPro801・TCでは、試 料を注入した状態で温度を変える事が出来る。逆に、殆ど変化を見せない蛋白質もある。この様な蛋白質は、粒径分布という見地からは、何度で結晶化を始めても、少なくとも開始時点では同等である。
4. 動的光散乱の特長と限界
動的光散乱測定の主な特長を挙げる。
(1)比較的少量の蛋白質溶液で測定することが出来る。DynaPro801-TC(Protein Solutions)での測定に必要な溶液量は150トl程度である。通常のフィルターの代わりに、デッド・ポリユームの少ない専用フィルター(MicroFilterキット/Protein Solutions)を用いると、501μl程度で測定可能である。
(2)可視領域のレーザー光が微小体積に当たるだけなので、蛋白質の損傷が少ない。フ ィルターに吸収される分を除き回収可能なので、測定に使用した溶液を、結晶化に用いることが出来る。
(3)短時間で容易に測定できる。DynaPro801では、1サイクル(1測定)15-60秒程 度である。結晶化のみならず、蛋白質の精製過程でも、分子サイズのチェックに利用されている。
動的光散乱の測定原理から、次のような測定上の限界を知ることが出来る。
(1)ベースラインが安定しない試料は、測定が難しい。ベースラインが安定しない理由 は色々あるが、蛋白質溶液中に大きな粒子が存在し、ゆっくりと漂っていると考えられる場合に頻繁に見られる。この様な場合は、ベースラインが決定できない程、粒径が不揃いだと判断できる。塵と気泡の混入にも気を付けなければならないが、初めから径の小さいフィルターを用いるのは危険である。全ての蛋白質がフィルターに掛かってしまい、貴重な試料を失う恐れがあるためである。
(2)散乱断面積の小さい蛋白質溶液は、測定しにくい。蛋白質が比較的小さく(く1万) 低濃度の場合は、十分な散乱強度が得られず、測定できない場合がある。照射する体積を増やして、シグナル成分を増加させることは、原理上できない。光源の輝度を増すと、蛋白質に影響が出る恐れがある。
(3)最終的な粒径の算出には、溶媒の粘性が直接作用する。グリセロールやPEGなど、 粘性の高い物質が蛋白質溶液に入っている場合は、正しい粘度を用いないと、粒径の推定値がかなり不正確となる。これに関連して、蛋白質の形状が球状蛋白質から大きくはずれる場合も、分子量の推定値が実際の値よりかなり大きく見積もられる。
(4)どの程度分布が狭ければよいのか、客観的な判断基準がない。リゾチームなど、結 、晶化が成功している蛋白質の分布と比較して、相対的に判断するしかない。
5. まとめ
動的光散乱は、揺らぎの速さを白己相関係数を用いて評価し、蛋白質溶液の粒径分布を 測定する方法である。結晶化に適した蛋白質溶液は、粒径が揃っているという経験則から、結晶化の難易・対策の指針を得ることが出来る。粒径分布が広い場合は、物理的・化学的な方法を用いて、分布が狭くなるように手を加えればよい。ただし、単分散の溶液が得られても、経験的に確率が高いと言うに過ぎず、必ず結晶化に成功するという保証はない。
動的光散乱は、結晶化条件が未知の蛋白質のみならず、これまで得られていた結晶が得 られなくなった場合でも、原因を推定する助けとなる可能性もある。リゾチームの結晶化は、100人行うと99人が結晶を得られると言われている。運悪くその1人に当たってしま った人は、試料を疑ってみたらいかがだろうか。室温に放置したリゾチーム溶液は、比較的短時間で粒径がばらついてくる。
参考文献