はじめに
C型肝炎ウイルス(HCV)の感染者数は、日本だけでも200万人以上と推定され ている。HCVは、感染・発病すると肝硬変、肝細胞がんと進行していく、難病を引 き起こすウイルスのひとつである。現在のところC型肝炎の治療法は、一部に有効 性のあるインターフェロン療法以外知られていない。
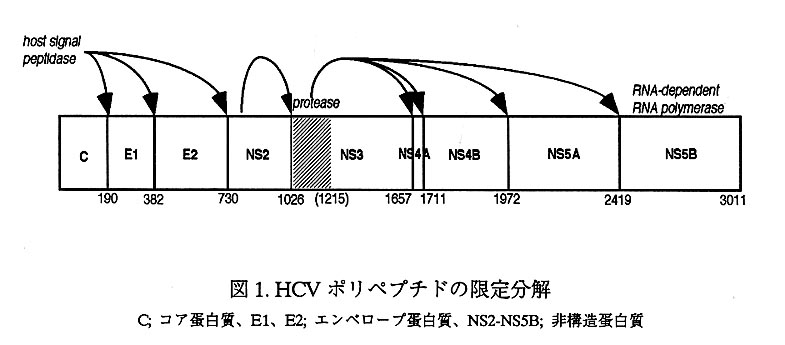
HCVは黄熱病ウイルスに代表されるフラビウイルスの一種に分類されており、約 9,400塩基からなる十鎖の一本鎖RNAをゲノムに持つ。ここに約3,010から3,033 アミノ酸残基をコードする長い翻訳領域が存在する(1)。翻訳されたポリペプチド は、宿主細胞由来のシグナルペプチダーゼにより限定分解を受け、非構造(Non- Structural;NS)蛋白質が連なったNS2-NS3-NS4A-NS4B-NS5A-NS5Bとなる(図 1)。この非構造蛋白質領域には、このポリペプチドをさらに限定分解する2種類 のプロテアーゼがコードされている。ひとつはNS2-3にまたがった領域にコードさ れている金属プロテアーゼであり、NS2-NS3の間を自己消化する。その結果、次の プロテアーゼ(NS3プロテアーゼ)が活性化され、そのC末端のNS3-NS4A間をシ ス切断し、NS4A-NS4B、NS4B-NS5A、NS5A-NS5B 間をトランス切断する(2)(図 1)。この限定分解により、例えばRNA依存型RNAポリメラーゼ活性を有する NS5B蛋白質(3)が活性化されウイルスの複製が開始される。このように、NS3の もつプロテアーゼ活性は、HCVのライフサイクルにおける重要な鍵となっている。

HIVやインフルエンザウイルスのような他のRNAウイルスと同様、HCVは複製 の際の突然変異率が高く、ワクチンの作製は困難である。これに対して、NS3プロ テアーゼの領域は、HCV種間でそのアミノ酸配列が特によく保存されていることか ら、このプロテアーゼ阻害剤はHCVの治療薬となりうる可能性が高く、治療薬開 発の重要なターゲットのひとつと考えられている。すでにいくつかの研究グループ が、HCVのNS3のプロテアーゼ領域の立体構造の構造決定に成功して(4、5)、 SBDD(Structure Based Drug Design)による創薬に生かそうという試みがはじまっ ている。
ここでは、筆者らがすでに報告した組換え体NS3プロテアーゼの結晶構造(4) に基づき、NS3プロテアーゼ領域の構造、活性部位における基質との相互作用、金 属(亜鉛)結合部位の推定、プロテアーゼの補因子といわれているNS4Aとの相互 作用について概説する。
1)組換え体NS3プロテアーゼの生産精製と結晶構造
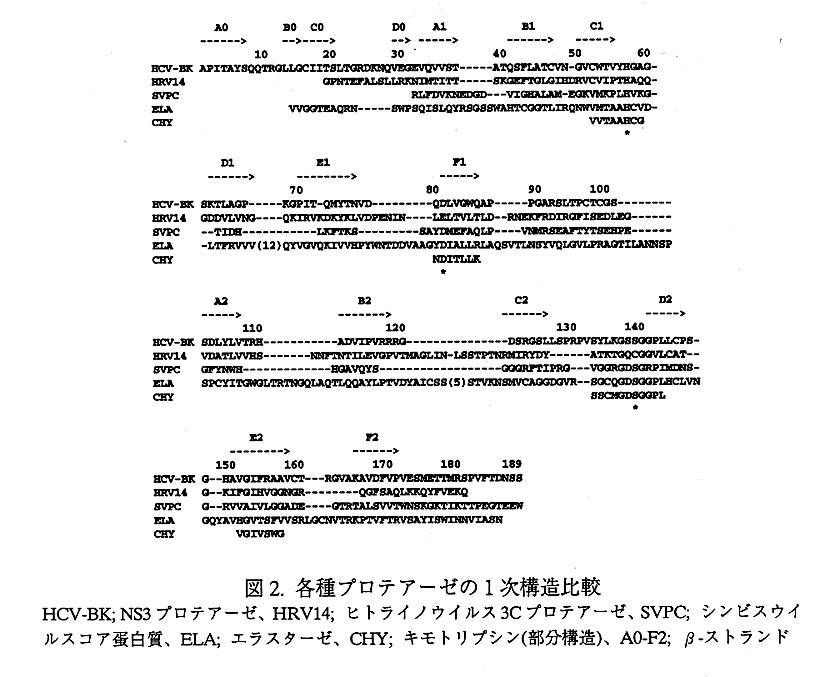
HCV NS3領域は、631アミノ酸からなり、そのN末端の1/3の領域にプロテ アーゼ活性が、そして残りのC末端2/3にRNA(DNA)へリカーゼ活性および NTPアーゼ活性が存在する(6)。また、N末端約200残基中のHis-57、Asp-81、 Ser-139(それぞれNS3領域のN末端からの番号)付近のアミノ酸配列が、キモト リプシンに代表されるセリンプロテアーゼに必須な3つの活性残基(トライアー ド)付近のそれと相同である。そこで、NS3プロテアーゼがセリンプロテアーゼで あると予測され、この3つのアミノ酸残基が活性トライアードであることが推測さ れていた。ところが、このトライアード付近を除くアミノ酸配列は他のプロテアー ゼとの相同性が低く、蛋白質全体の構造を予測することは困難であった(図2)。
そこで、NS3のどの領域がプロテアーゼ活性を担うのか、あるいはNS3全領域が その活性の発現に必須であるのかについての研究が盛んに行なわれた。NS3のN末 端およびC末端からシステマティックに短縮した遺伝子を用いた組換え体蛋白質に よるウイルスのポリペプチドのプロセシングをみることで、そのプロテアーゼ活性 に必要な領域が検討された。
筆者らは、4つの代表的なHCVのH、BK、J6、J8型遺伝子を用い、組換え体 NS3プロテアーゼ生産を試みた。様々な組換え体を検討した結果、下遠野らのプロ テアーゼ活性の必須領域に関する報告(7)に基づき、BK型遺伝子から1-189アミ ノ酸領域がプロテアーゼ活性のある蛋白質として大腸菌で生産される事を見出した。 そして、その高い等電点を考慮して陽イオン交換体などのカラムクロマトグラフィ 一により、プロテアーゼ活性のある単一蛋白質として精製し、このNS3プロテアー ゼの結晶化と構造決定を行った。
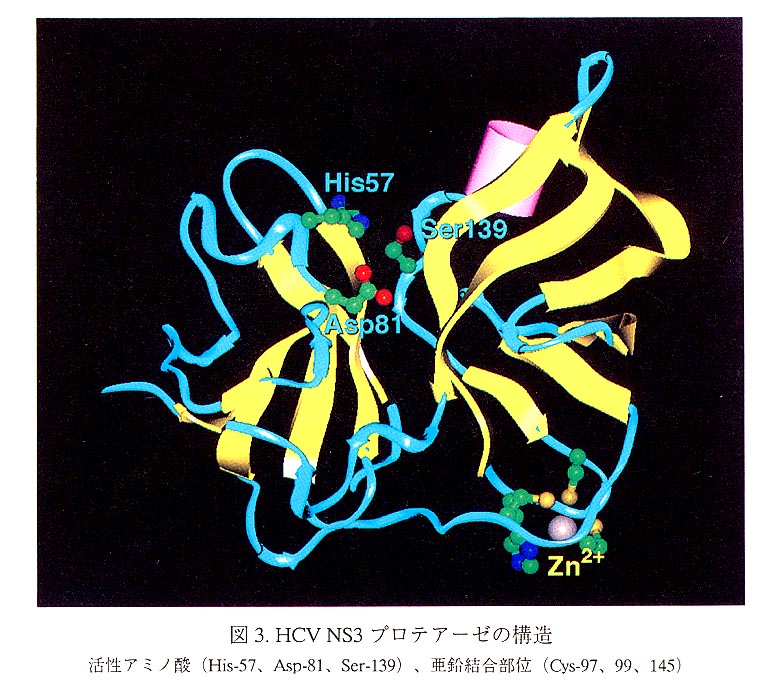
解かれた結晶構造から、NS3プロテアーゼは6つのβストランドからなる2つの バレル構造が向き合った、キモトリプシンやトリプシンなどに見られる典型的なセ リンプロテアーゼ構造をとっていることが明らかにされた(図3)。一方、189ア ミノ酸からなるこのNS3プロテアーゼでは、活性部位の溝に突き出したそれぞれ2 本のβストランドによって形成されるループは、およそ220アミノ酸からなるキモ トリプシンやトリプシンに比べて短く、約30アミノ酸残基分小さいために、コンパ クトで経済的にまとまっている(図2)。蛋白質骨格の全体の折れ畳みは、哺乳動 物由来のセリンプロテアーゼよりも、プロテアーゼとしてコンパクトなライノウイ ルスの3Cプロテアーゼやシンビスウイルスのコア蛋白質(プロテアーゼ)に近い。
2)活性部位の構造
NS3プロテアーゼの結晶構造では、S1ポケットは側鎖の大きい非極性アミノ酸 Phe-154の芳香環が、ポケットの中央横から突き出ており、さらにAla-157やLeu-135の側鎖もやはり横から伸びており、P1部位の側鎖が結合する穴の大きさはキモ トリプシン、トリプシンのS1ポケットより浅い。したがって、基質となる非構造 蛋白質の切断部位のP1部位にあるトレオニンあるいはシステイン残基の小さなア ミノ酸側鎖がうまく納まる大きさである。すでに述べたように、活性部位を形成す るふたつのドメイン間に突き出たループが全体に短くなっているために、基質の P2-P5部分と相互作用する蛋白質表面もキモトリプシンなどと比べ、なだらかで広 い。一方、基質となるポリペプチド切断部位のP6からP2'にあたるアミノ酸配列 は、BK型HCVの場合、3-4A、4A-4B、4B-5Aそして5A-5B部位で、それぞれ、 DLEVVT/ST、DEMEEC/AS、DCSTPC/SG、EDVVCC/SMである。ここで、 P6位の酸性アミノ酸、P1位のトレオニンあるいはシステイン、そしてP1’のセリン あるいはアラニンがくることを除けば、P2-P5部位にアミノ酸の一次配列に見るべ き相同性はない。
さらにS1ポケット付近の構造を他のプロテアーゼと比較すると、NS3プロテアー ゼにおいては、Ala-157とVal-167がSlポケットの入口付近にあり、ポケットの間口 を規定している。これらに相当するアミノ酸残基は、キモトリプシンとトリプシン で共にグリシン残基となっており、基質のP1に特異的な残基はそれぞれチロシン、 トリプトファンそしてリジン、アルギニンなどであり、大きな側鎖を受け人れる深 いポケットを持つ。これに対して、P1の基質特異性がアラニンなどのような小さ い疎水性側鎖をもつアミノ酸残基のエラスターゼでは、これらのアミノ酸残基はそ れぞれバリンとトレオニンとなっている。
活性セリン(Ser-139)付近のアミノ酸配列は、NS3プロテアーゼにおいても、 Gly-Ser-Ser-Gly-Glyとなっており、トリプシン様プロテアーゼに特徴的なGXSGG モチーフとなっている(図2)。プロテアーゼによる加水分解の中間体、四面体遷 移状態(オキシアニオン)を安定化させるといわれている135から139のアミノ酸 残基のペプチド骨格からなるループや、150-158のアミノ酸残基からなるE2のβス トランドが、基質結合部位を形成している。また、他のプロテアーゼにみられない C2-D2間のループに存在する1ターン分のαへリックス(131-134)は、このプロテア ーゼの特徴であり、オキシアニオンホールを形成するループの直前に位置する。こ のへリックス形成により、基質結合部位が構造的に安定化している可能性がある。
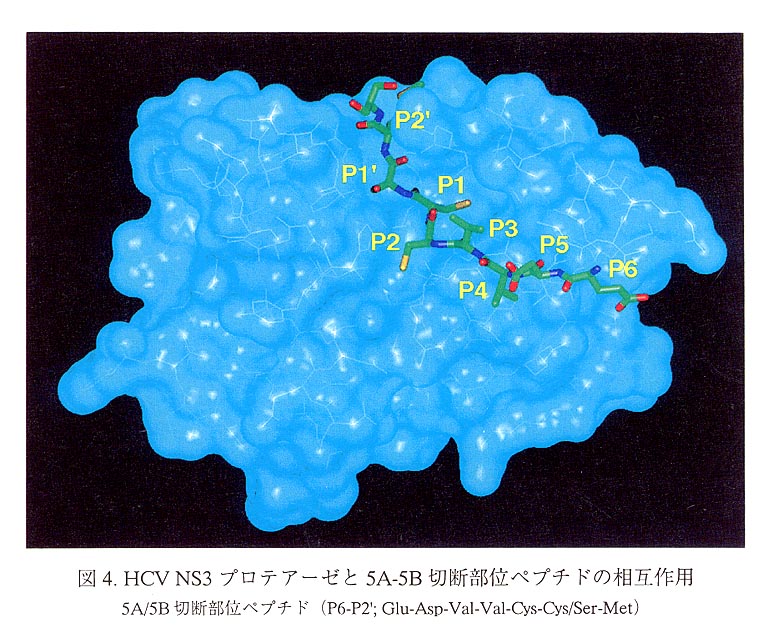
以上に述べた構造上の特徴に基づき、5A-5B部位の基質ペプチド(P6からP21ま で)がNS3プロテアーゼに結合した複合体モデルを示す(図4)。このモデルよれ ば、S1ポケットにはP1のシステイン側鎖が納まり、Phe-154の電子供与性である ベンゼン環のπ電子雲とシステイン残基のチオール基が広義の水素結合を形成して おり、P1の基質特異性をうまく説明できる。P2-P3の部分は、なだらかなNS3プロ テアーゼの活性部位付近のくぼみに横たわっている。すべてのポリペプチド切断部 位のP6残基は負に荷電した酸性アミノ酸となっているが、モデル中、P6のグルタ ミン酸側鎖のカルボキシル基近傍には、塩基性アミノ酸残基のArg-161とLys-165 の正に荷電した側鎖があり、基質の結合に寄与していると考えられる。
3)亜鉛結合モチーフ
HCVのポリペプチドのプロセシング過程を再現した試験管内蛋白質合成系を用 いたプロテアーゼ活性は、水銀や銅などの重金属イオンにより抑えられ(8)、また 亜鉛添加により促進される。また、組換え体NS3プロテアーゼの活性測定の際、 EDTA等のキレート剤が活性を阻害することも知られており、金属イオンがこの NS3のプロテアーゼ活性に深く関与していることが推測された(9)。
NS3のプロテアーゼ領域189アミノ酸残基中の配列をH、BK、J6、J8:型の間で 比較してみると、BK型で7つあるシステイン残基の内、Cys-97、99、145、159が 保存されている。部位特異的変異体を用いた活性測定から、Cys-97、99、145がプ ロテアーゼ活性に必須であった。保存されているCys-159を含む4つのアミノ酸変 異体(C16A、C47S、C52LそしてC159S)は、野生型と同等のプロテアーゼ活性 を有していた(未発表データ)。最近、野生型並びに4アミノ酸変異体は、蛋白質 分子あたり1分子当量分の亜鉛を含有していることが質量分析計による元素分析の 結果から明らかとなった(9)。
NS3プロテアーゼの結晶構造において、亜鉛結合部位のCys-97、99、145の3つ のシステイン残基の硫黄原子と亜鉛の原子間距離は、2.0から2.5Åとなり、各原子 はほぼ正四面体の頂点に位置し、その近傍にHis-149が存在する(図3)。この亜 鉛結合部位は、酵素活性部位から遠く離れており、触媒機能に直接関与していると 言うより、蛋白質の構造保持に寄与しているものと思われる。このqs-97、99、145 とHis-149に代表される特徴的なCXC---CXXXHあるいはCXHのキレートモチー フは、他に、HGV、GBウイルス、ライノウイルス、ポリオウイルスのプロテアー ゼにも見つかっており、新しいタイプの亜鉛結合モチーフの可能性がある(9)。
4)NS4A蛋白質の影響
HCVは、他のフラビウイルスにはないNS4Aという54残基からなる小さい蛋白 質をコードしている。この蛋白質はNS3のプロテアーゼ活性を上昇させる補因子と しての機能を持つ(10)。特に、NS4A/4Bの間の切断を強く促進し、NS4B15Aの間 の切断には必須であることが知られている(11)。NS4Aは、NS3蛋白質のN末端 部位と結合し複合体を形成した後、NS4AのN末端側の疎水性アミノ酸領域を介し て細胞膜と相互作用することが示唆されている(12)。
筆者らのNS3プロテアーゼ単独の構造と、Kimらが報告したNS3プロテアーゼ とNS4Aの21から39番の残基を含む部分ペプチドとの複合体の構造(5)を比較 すると、NS3プロテアーゼ単独では、そのN末端部分はほどけている。それに対 し複合体中では、このNS4Aのペプチド鎖とNS3プロテアーゼのA1のペプチド鎖 などとβシートを形成して、球状蛋白質の一部として組み込まれている(5)。NS3 プロテアーゼ単独の場合、そのN末端部位には、Val-33、Val-35、Leu-44、Leu-94、 Val-107、Leu-127、Ala-111、Val-113、Pro-115、Pro-142、Leu-144、Tyr-105(側鎖)、 Arg-109(主鎖)からなる、約20x8Åの広い疎水領域が形成される。興味深いこと に、NS4A部分のないプロテアーゼ単独の結晶構造では、隣あるいは両隣に存在す るプロテアーゼのほどけたN末部分が、あたかもNS4Aペプチドの如く、この疎水 領域と互いに結合し安定化しているように見える。NS4A蛋白質は、疎水性のアミ ノ酸に富む配列を有しており、NS3プロテアーゼのこの疎水性領域と強く相互作用 し、互いに安定化して活性を増大させているのかもしれない(4)。
おわりに
C型肝炎ウイルスのNS3のプロテアーゼ領域について、新たに解明された結晶構 造に基づいてそのプロテアーゼ活性と立体構造との関連について述べてきた。本酵 素は、基質との相互作用、また補因子であるNS4Aとの相互作用から、今までにな い特徴を持つセリンプロテアーゼであることがわかった。蛋白質結晶構造解析で得 られたNS3プロテアーゼの立体構造は、阻害剤の創出に大きな一助になるものと考 えられる。
ここで得られた構造はNS3プロテアーゼ領域に対するもので、ウイルスゲノムに コードされている天然型酵素そのものではない。天然では631アミノ酸残基からな るNS3蛋白質と54アミノ酸残基からなるNS4A蛋白質が複合体を形成して生体中 で機能していると考えられる。NS3の一部分である1-189アミノ酸からなるプロテ アーゼ領域は、この天然型のNS3-4A複合体とは、基質の認識、相互作用において 幾分なりとも異なる可能性が否定できない。
最近、NS3の残りの部分であるC末端側2/3の領域にコードされるヘリカーゼ 領域の結晶構造が報告された(13)。NS3蛋白質が持つ全く異なる2つの酵素活性 が、ウイルス感染・増殖の中で具体的にどのように機能しているのかは興味深い。 さらに、HCVウィルスの複製において、細胞内で共役的に作用していると考えられ るNS3-4AのヘリカーゼやNTPアーゼ活性と、NS5BのRNA依存型RNAポリメ ラーゼ活性の相互作用や調節機構の解明が待たれる。これらの諸問題をひとつひと つ解決していくなかから、C型肝炎という難病を根治する新たな糸口が見えてくる ものと信じている。
最後に、この研究成果は、Agouron Pharmaceuticals, Inc.との共同研究により得 られたものである。また、図の作製と有益な助言をいただいた官野雅司、八浪公 夫両氏をはじめ、JTの皆様に感謝します。最後に、放射光の利用に協力いただき ました坂部知平氏ほかPFのスタッフに感謝します。
参考文献