クロマトグラフィーは時間浪費型の分離精製技術か?
液体クロマトグラフィーは、ライフサイエンスにおける研究に不可欠な重要技術である。 複雑な生体高分子としての生理活性物質の分離と分取を可能にする緩和な条件と組み合わ せることにより、多種多様な混合物中の極くわずかに異なる変異体さえも精製する事ができ る。クロマトグラフィーは、直径1mm以下のカラムを用いたng量以下の微量試科の分析 から、直径1mもしくはそれ以上のカラムによる数kgスケールのバルク医薬品の製造まで、 広い範囲で利用できる。しかし、殆どの場合、分離した物質が、最重要出発点にはなるもの の、クロマトグラフィー自体は研究対象ではない。クロマトグラフィーが時間浪費型の分離 精製技術であるために、クロマトグラフィーによる分離と分取は、そのプロジェクトの最も 退屈な部分となる傾向にある。クロマトグラフィーには高純度物質を得るための種々の分離 モードが有しているにも拘わらず、最も厄介な問題の一つは、実際のクロマトグラフィー分 離用プロトコールや精製条件の最適化に長時間を要する事である。目的の生体分子と試料マ トリックス双方の複雑性と、クロマトグラフィー技術の幅広い柔軟性が原因で、分離に影響 するパラメーター全部を理解したり設定する事が難しく、またそれ以上に最適化は困難なも のである。理想的な精製条件の開発には、分離に影響しそうなパラメーター各々について、 順序立てて総合的に評価するような、系統的な実験アプローチが必要となる。
しかし、従来のクロマトグラフィーの場合、通常の流速以上の高流速での分離が困難であ るために、そのような系統的なアプローチは不可能である。従来の充填剤担体では、1回の クロマトグラフィー操作に要する時間は、30分から1日もしくはそれ以上というのが一般 的であり、それは充填剤担体の性質に負う所が大きい。従って、効率的な分離条件の最適化 を図るために、過去の経験、仲間の助言、または過去の発表論文等を参考にし、それを出発 点とする事が多い。しかしながら、一応用例に関する過去の経験では直面する課題に対して 適切でない場合が多く、その結果として、不満足な分離結果を受け入れざるを得ず、さらに、 それが最適条件か否かを見極めることもできない場合が多い。全く新しい分離上の課題に直 面した際は、長い「試行錯誤」の条件設定が唯一の方法となる。
従来のクロマトグラフイーの限界
現在利用可能なほとんどのクロマトグラフィー用担体では、速度、分離、吸着能の間でト レードオフが成立する。この3者の関係は頂点ごとにパラメーターを当てはめた三角形で表 現することができる。これらのパラメーターは相互依存関係にあるため、分離や吸着能の向 上には速度を犠牲にする必要があり、また速度を増すには分離または吸着能を犠牲にしなけ ればならない。

このトレードオフは、従来のクロマトグラフイー用担体に 用いられる粒子の特性に基づいており、クロマトグラフィ 一分離が生ずるためには、液体中の分子は担体粒子表面と 相互作用を起こす必要がある。通常、クロマトグラフィー 粒子は内部表面を最大にするために超多孔性を有しており (100〜1000Aのボア)、液体中の分子は、カラムの充填カ ラムベッドを流れる液体に沿って粒子の周囲を移動する。分子の粒子内部への移動は、ポア 内での拡散によって起こる(粒子内拡散)。特に巨大分子においては、拡散の為に十分な時間 を必要とする。このことは、従来のクロマトグラフィー分離における前提条件となっている。 カラム内を通過する流速の増加に伴い、粒子内拡散が起きる時間が短縮され、その結果、分 子と粒子内部表面との相互作用を起こす能力が低下する。したがって、遠すぎる流速ではバ ンドが広がり、分離度および吸着能が低下する。粒径90-200μmの第1世代の生化学用ク ロマトグラフィー充填剤(いわゆるソフトゲル)では、1回の分離は、通常数時間から数日の 単位であった。
新しい高性能液体クロマトグラフィー(HPLC)用充填剤の導入で、スピードは第1世代充 填剤の10倍速くなった。HPLCでは、粒径を3-30μ血に小さくすることで、高速分離が 可能となり、粒子内での拡散距離を短縮することで、従来より遠い流速での操作が可能にな った。しかし、これはHPLCでの流速の相対的改善であり、粒子構造そのものの進歩によ る前進ではない。既存のHPLCカラムでは、拡散は依然としてバッファー流速に制限を受 けており、典型的な「ラボスケール」サイズのHPLCカラムで、分離度や吸着能を低下さ せない範囲では、通常1ml/min以上の流遠では操作できない(分離時間は30分〜1時問)。
新しいアプローチ
PerfLlsion ChromatolgraPhyは、
1989年にPerSeptive Biosystems
社によって開発され、クロマトグラ
フィー用粒子の設計上における根
本的な技術革新がもたらされた(図
2,3)。POROS担体は、従来のクロ
マトグラフィー用担体の拡散によ
る分子移動の限界を克服したもの
で、クロマトグラフィー用粒子内部
に画期的な速さで行き渡るように
設計されている。
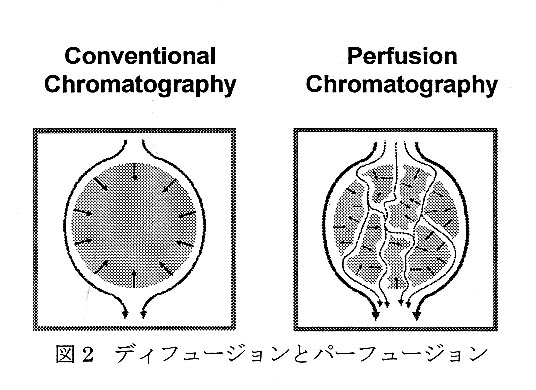

従来のクロマトグラフィー用粒子とは具なり、 POROS粒子は、2種類のタイプの異なるボア (孔)を有している。粒子を貫通する巨大な貫通孔 と、貫通孔から枝分かれした短い吸着孔であり、 液体1粒子間で相互作用が起きる内部表面積が 大きくなっている。充填カラム内のフローによ って貫通孔への流れが促進され、各粒子間に圧 力差が生じる。試料分子はこの貫通孔フローに よって粒子内部へと運ばれ、吸着孔の網目構造 と接触する。粒子の直径に比較して吸着孔の長さが短く(1μm以下が普通)、試料分子の内部 吸着サイトへの、そして吸着サイトからの貫通孔フローへ戻るのに要する時間が非常に短縮 された。
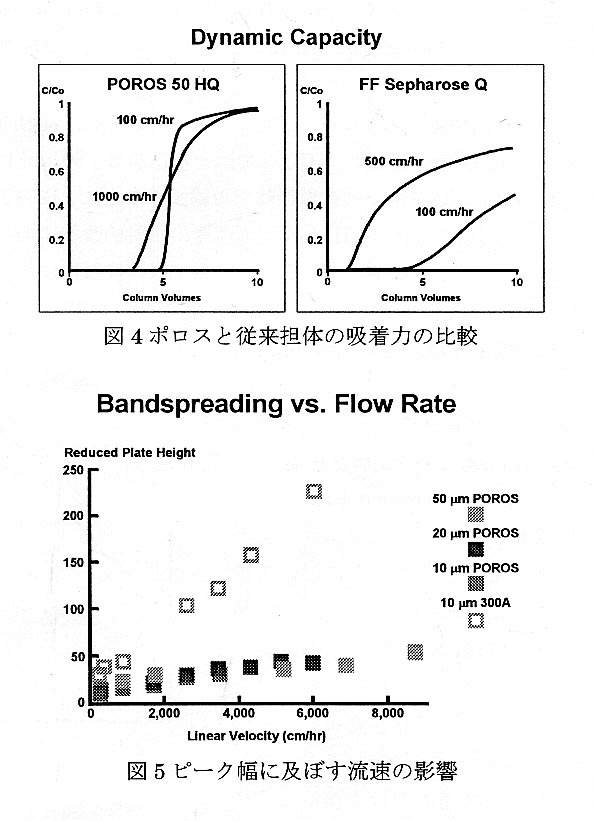
粒子内フローと短い吸着 孔との組み合わせにより、 同様の効果を拡散のみに依 存する従来の担体に比較し て、画期的なスピードで、 粒子内部の全表面との接触 が可能になった。Perfusion Chromatography 用担体で は、分離度や吸着能をほと んどロスすることなく、迅 速な分離が可能である(図 4,5)。
Perfusion Chromatography の特徴と応用
Perfusion Chromatography では、従来のHPLCカラムの10倍以上という迅速性が利点 であり、典型的な実験室スケールサイズのカラムでの分離時間を、3-5分に短縮した。 POROS担体を用いたPerfusion Chromatography は、ライフサイエンス分野の研究におい て、クロマトグラフィーの使用法や考え方を一変させた。これまでのクロマトグラフィーの トレードオフのほとんどは、もはや過去の問題となり、新しい応用への可能性が開けたとい える。
精製条件確立の改善と簡素化
Perfusion Chromatography によってもたらされる進歩の中で最も重要なメリットは、最 適精製条件の開発における実用的でシステマチックなアプローチ法である。この方法は今ま で述べてきたクロマトグラフィーの問題点の多くを解決できる。操作時間の短縮化により、 従来のクロマトグラフィー用担体を使用した場合の1回の操作時間で、全精製工程を完了さ せることが出来る。この能力を利用すれば、分離における様々な挙動について、実験データ 一を手に入れながら、分離上重要なパラメーターを一度に調べることが可能であり、これに より最適プロトコールを個々の試料について実験的に作成できる。システマチックなアプロ ーチ法の重要性として見逃すことが出来ないこととして、本法を実施することにより、対象 とする目的分子のクロマトグラフィーにおける挙動を分離パラメーターと関連付けて学習 できることである。
生理活性物質の回収率の向上
Perfusion Chromatography において達成された操作の迅速性は、精製の間に変性が促進 されるような条件下に目的分子が存在する時間が、従来のクロマトグラフィーに比較して極 めて短いことになり、試料中に存在する可能性のある分解酵素との接触時間も短いことを意 味する。これらのファクター全部が、生物活性物質の収率に著しい影響を与えることになる。 カラムサイズの縮小大量の試料精製の場合でも、高速のPerfusion Chromatography では比較的小さなカラムを用いることが出来る。ポロスでは、同じ時間内で既存のカラムよりも迅速に、多数回の操作が可能であり、従来では大容量カラムでの精製が必要な多量の試料精製が、ボロスでは同 じ時間内で小サイズのカラムを用いた数回の精製で実現できる。このことは、スケールアッ プ時のコストを低下させ、またシステマチックなアプローチ法による最適化を行っているた めにより確かな精製を行うことが出来る。
分析技術における重要な利点
クロマトグラフィーは、分取目的以外にも分析用として、しばしば利用される。定量すべ き試料や分画が多数の場合、迅速な分析方法が必要である。POROSを用いるクロマトグ ラフィーアッセイは、時間節約の観点からの効果のみならず、効率の点でも効果的な場合が ある。たとえば、もし定量分析が数分から数秒に短縮可能であれば、目的物の精製カラムか らの溶出をリアルタイムでモニター可能であり、その結果、目的物が存在するときにのみフ ラクションをすることが可能である。このアプローチ(PerSeptive Biosystems社'Real Time Process Monitor (RPMR)System)により、回収された分析すべきフラクション数が大幅に 減少し、また目的物を高純度で回収出来る。
新規アッセイ技術の開発
Perfusion Chromatography の高速性は、まったく新規のアッセイ技術を多数実現できる。 例えば、POROS担体に抗体を固定化するImmuno DetectionTMカートリッジによって、カ ラム上での迅速なイムノアッセイが可能である。非常に短い拡散流路、広い表面積、および 迅速な洗浄により、従来のマイクロプレートを利用したイムノアッセイで数時間要したアッ セイを数分に短縮可能である。また既存のHPLC装置の利用による完全自動化も可能であ る。POROSパーフュージョンクロマトグラフィー用担体に固定化した酵素(PoroszymeTM) は、タンパク質の消化やその他の分析プロセスを、酵素の自己消化をおこすことなく従来よ りも大幅に迅速かつ効果的に進めることが可能である。操作時間の短いパーフュージョンク ロマトグラフィー用カラムでは、異なる複数の分離モードのカラムを組合せる分析が実用的 になる。たとえば、抗体を固定化したImmnoDetectionカートリッジは、特定の生体分子を 複雑な生物試料から迅速に単離が可能であり、さらにIDカートリッジで単離した日的分子 を直接、逆相カラムに導入し分離させることで、さらに細かく単離することができる。キヤ ピラリーカラムに充填した Perfusion Chromatography 用担体は、質量分析計に直接連結す ると、微量試料のより効率的な検出が可能となる。高速担体と多機能の自動化装置 (PerSeptive Biosystems 社 インテグラルマイクロアナリティカルワークステーション)を 組み合わせることにより、従来では考えられなかったような、クロマトグラフィー上の多数 の難しい課題を解決する、多次元クロマトグラフィーアッセイの開発が実現できる。
多様性に富むPerfusion Chromatography
Perfusion Chromatography 技術の基本的な性能特性(高速での分離度ならびに吸着能)は、 スチレン1ジビニルベンゼン共重合体(PSDVB)を素材としたボロス担体の持つユニークなポア構造に起因する。この粒子は本来疎水性であり、逆相分離用として利用可能である。その 他の分離モードに適した充填剤は、素材のPSDVBをさらに親水性ボリマーでコートした後、 イオン交換、疎水性、アフィニティ、反応性官能基、および金属キレートなどのクロマトグ ラフィー用官能基を導入したものである(表1)。

各分離モードの中でも、POROS充填剤には、さらに官能基(分離)に選択の幅がある。 たとえば、カチオン交換クロマトグラフィーについては、4種類の具なるPOROS充填剤が 用意されており、それぞれ異なったイオン交換基や密度を有している。一連のシリーズの各 充填剤の分離パターンは、試料の特性に依存して大きく異なって来るために、最適な精製条 件を確立する場合には官能基の選択の幅は重要である。
応用例
X線結晶構造解析のためのテトラヒドロ葉酸依存酵素の精製
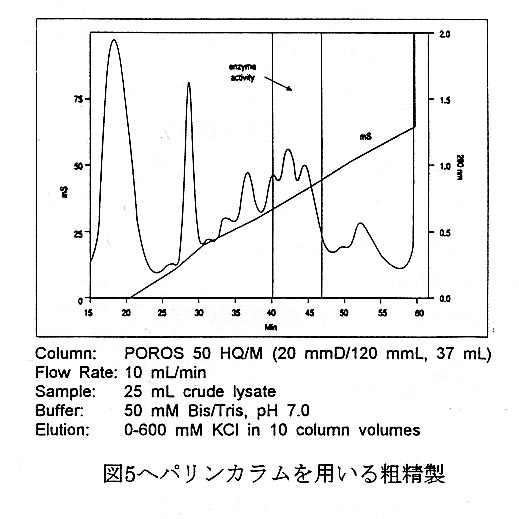
5Lの培養液から回収した15gのバク テリアを5%グリセロール含有の 10mMトリス塩酸(pH6.9)に懸濁し、 超音波処理した後、超遠心(20000rpm, 20分)により不溶物を除去し抽出液を 得た。粗ライセート(25mL)をPOROS 50HQ(20mmD/120mmL,50μm)強 アニオン交換カラムにロードした。酵素 活性は400〜450mMのKCl濃度にお いて認められた(図5)。活性画分を50 mMビス/トリス(pH7.0/β- mercaptoethanol)中で一夜透析し、へ パリンカラムによる第2段階の精製に 供した。
POROS20HE(4.6mmD/100mmL,20μm)へパリンカラムによる、溶出液の最適pH を検討した結果、pH7.0が最適と判断された(図6)。次いで、50mLの透析液をへパリ ンカラムにアプライし精製した。この精製に要した時間は10分であった(図7)。
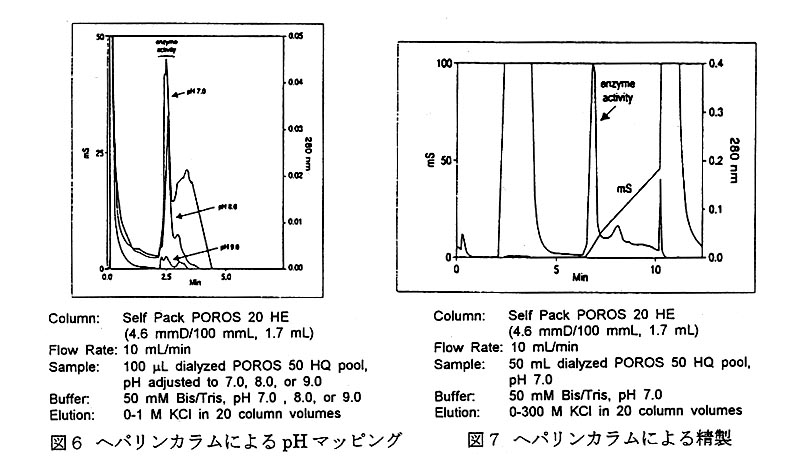
最終精製にはPOROS 20 HQ/M (4.6mmD/100mmL, 20μm)強ア ニオン交換カラムを用いた(図8)。 ヘパリンカラムにおける5mLの活 性画分をアプライし精製した結果、 400〜450mMのXCl濃度で酵素の 溶出が認められた。酵素の純度はゲ ル電気泳動から99.5。1。のであった。 結製された酵素から得られた結晶を 示す(図9)。
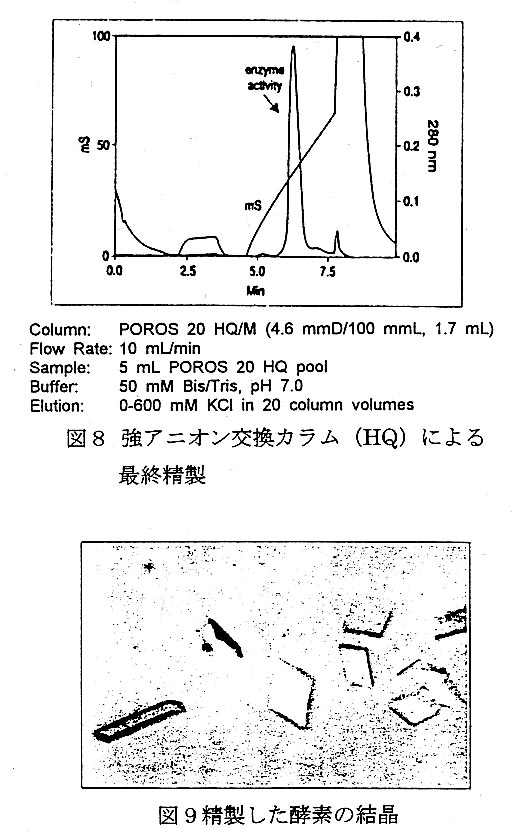
構造生物学においては、高い純度 の多量の試料が要求される。ここで 紹介した精製方法を用いることによ り、2日で純度99.5%の酵素を10mg 得ることが出来た。なお、本研究は Fred Hutchinson Cancer Research CenterのDavid Dyer等によって報 告されたものである。