1はじめに
生物体を形成する元素の一つであるイオウは炭素、酸素、水素、窒素などに次いで重 要な元素である。これらの元素は空気中、地球上、地球内部などあらゆるところに分布 し、長い年月の問に適当なバランスが成立し安定な状態を保持してきた。近年人類の諸 活動が盛んになるにしたがって生じて来た環境問題は、このような元素の存在状態のアンバランスとしてとらえることができる。二酸化炭素が空気中に増加したことによる温暖 化現象はその典型的な例である。化石燃料の大量消費によって、イオウ元素が大気中に 多量に放出され、いわゆる酸性雨の一因となっていることはよく知られている。一応の 対策が取られ、イオウ酸化物による環境汚染の問題は沈静化しているが、世界的な規模で考えればなお多くの課題がある。

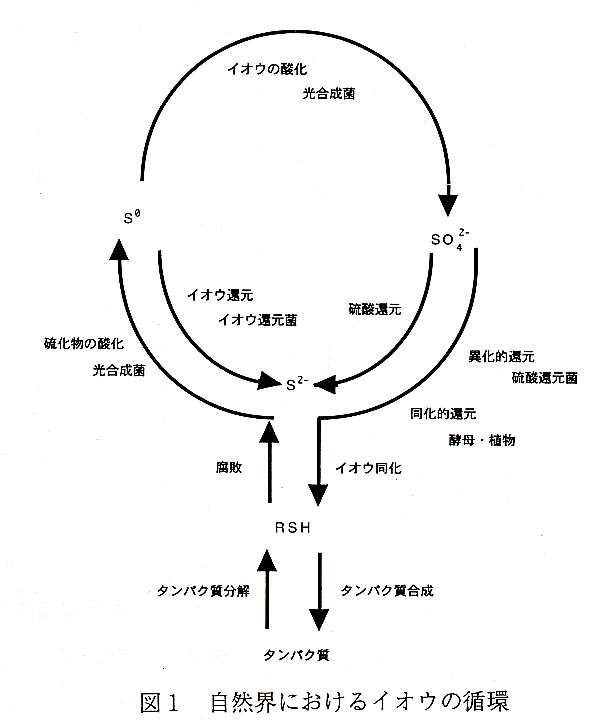
自然界におけるイオウの循環はおおよそ図1のようにまとめることができる。 元素の周期律表において、イオウはVIA族に含まれ、酸素と同じ族であるが、多様な原 子価をとる、その主な存在形態とその間の循環はこの図に示されている。
硫酸塩はイオウの存在形態としてはもっとも安定なものであるが、これを活性なかたち に変えて自然界におけるイオウの循環のなかへ組み入れる役割を担っているのが硫酸還元菌である。発生した硫化水素は紅色イオウ細菌、緑色イオウ細菌などの光合成菌の生育 に利用される。またフリーのイオウを利用するイオウ還元菌や光合成菌などもある。こ のようにイオウを介して共生関係を形成していると言える。硫酸還元菌は嫌気性であり、動物などが酸素を利用してエネルギーを得ているのになぞらえて硫酸塩呼吸と呼ばれているが、これは異化的な還元である。イオウの同化的な還元は植物や酵母などが担ってい て、動物はそれを摂取することでイオウ化合物を利用している。またラン色細菌は水 田をはじめとした土壌中に生育しており、優占種となることも多い。硫酸塩からフェレ ドキシンを介した還元によりシステインに組み込むことができる。また硫化物イオンを 利用するような酵素が誘導されることが見いだされている。
研究の出発点はチトクロムc3であった。硫酸還元菌にのみ存在するタンパク質であり、 マーカープロテインである、へムを4個持ち、酸化還元電位が-300mVと非常に低い値 をもつ。アミノ酸残基数は107個である。その特異な性質に興味をもってX線による構 造解析を行い、立体構造を明らかにした。1980年ごろのことである。4つのへムは、隣 りあうヘムが面を互いに直角に配置されておりへム鉄原子間の距離はほぼ12Åである。 Desulfovibrio vulgaris Miyazaki F と Desulfovibrio vulgaris Hildenborough のチトクロムc3の構造を報告した。
「構造と機能」という用語をしばしば使う。立体構造を解明する意義は機能を担って いる構造を明かにするためである。しかし解析に成功したからと言ってすぐに機能が 解明できるとは限らない。無理をするとスペキュレーションが勇み足となって後世に批 判を受けることになる。キモトリプシンがそうだし、リゾチームも怪しい。機能が充分 解明できなかったとしても構造が明かになればそれはきっと役に立つであろう。それ にしても電子伝達タンパク質というのはとくに機能を担う構造がはっきりしない。「基 質」が分子や原子でなく電子であるからである。さしあたっては揺らぐことのない構造 を提示することで満足することになる。
硫酸還元菌はへんてこなバクテリアである。農学系の方が土壌微生物学の立場で先1便 をつけられ、それに理学系の生化学の方が続かれた。タンパク質結晶学の者はいちばん 遅れて参加した。初期の方々はほとんど引退され後継者もいないようである。硫酸還元 菌は嫌気性細菌である。地球が誕生して間もなく、地球を包む気体はアンモニアや水素 などの還元性の気体であったがそのころに硫酸還元菌は生育していたのだと聞かされていた。そののち光合成菌が優勢となり、地球を酸素が覆うようになって嫌気性である硫 酸還元菌は地中に潜むようになったのだという。したがって進化的に非常に古いもの だそうである。
こういう話を無邪気に信じているのも変なことだが、かと言って嘘だという証拠もない ただ最近では先に述べたようにイオウの循環を媒介として他の微生物などと共生してい ると考えるのが妥当ではないかと思っている。水田や畑、沼地などで硫酸還元菌が生育 し、硫化水素を環境中へ放出して汚染するようなことがある。こんな状況が起こるのは 日差しが強くて好気性の細菌が大いに増殖するような場合である。そうすると土壌中の 細菌が住み着いているところの酸素が消費されて嫌気性になる。すると嫌気性の硫酸還 元菌が生育する条件が整うのである。そんな考えを持つようになったのは、解析したチ トクロムc3の構造を観察した結果の副産物である。進化的に非常に古いような特徴あ る構造をしているわけではない。きわめて近代的な構造を示していたからである。これ はもちろんジョークであるが、進化的に古いことは確認できなかったというべきであろう。それ以来硫酸還元菌のこのような特異な生態と、それを支える特異な酵素タンパク質 に興味を持ち、その立体構造を解明する課題と取りくむことになった。日の当らないと ころでひっそりと棲んでいる硫酸還元菌におのれの姿を重ねるような気持ちもあった。 つぎの課題はチトクロムc3の電子伝達の相手であるヒドロゲナーゼであった。
2 ヒドロゲナーゼ
系統名は、hydrogen;ferricytochrome c3 oxidoreductase (EC1.12.2.1)である。乳酸や酪酸 を分解して出る電子を得てプロトンから水素へ還元する働きと、水素を分解してプロトンに変え、そのときに生ずる電子を硫酸還元系に与えるという二つの役割をもつ重要な酵素である。二つのサブユニットから成り、大サブユニットはアミノ酸数566、小サブユニッ トはアミノ酸数267個、1分子量が全体で91,000に達する。金属を含む活性部位が4個あ る。4Fe-4Sが2個、3Fe-4Sが1個、Niが1個である。構造解析の結果、これらの活性 部位は分子の表面に近いところにほぼ直線状に配置されていることが分かった。その配 置は[4Fe-4S]-[3Fe-4S]-[4Fe-4S]一[Ni]の順であり、各クラスターの間隔は約12Åである。[Ni]のサイトにはさらにFeが存在することが分かった。全体の構造と[Ni-Fe]のサイト の原子配置を図2、3に示す。
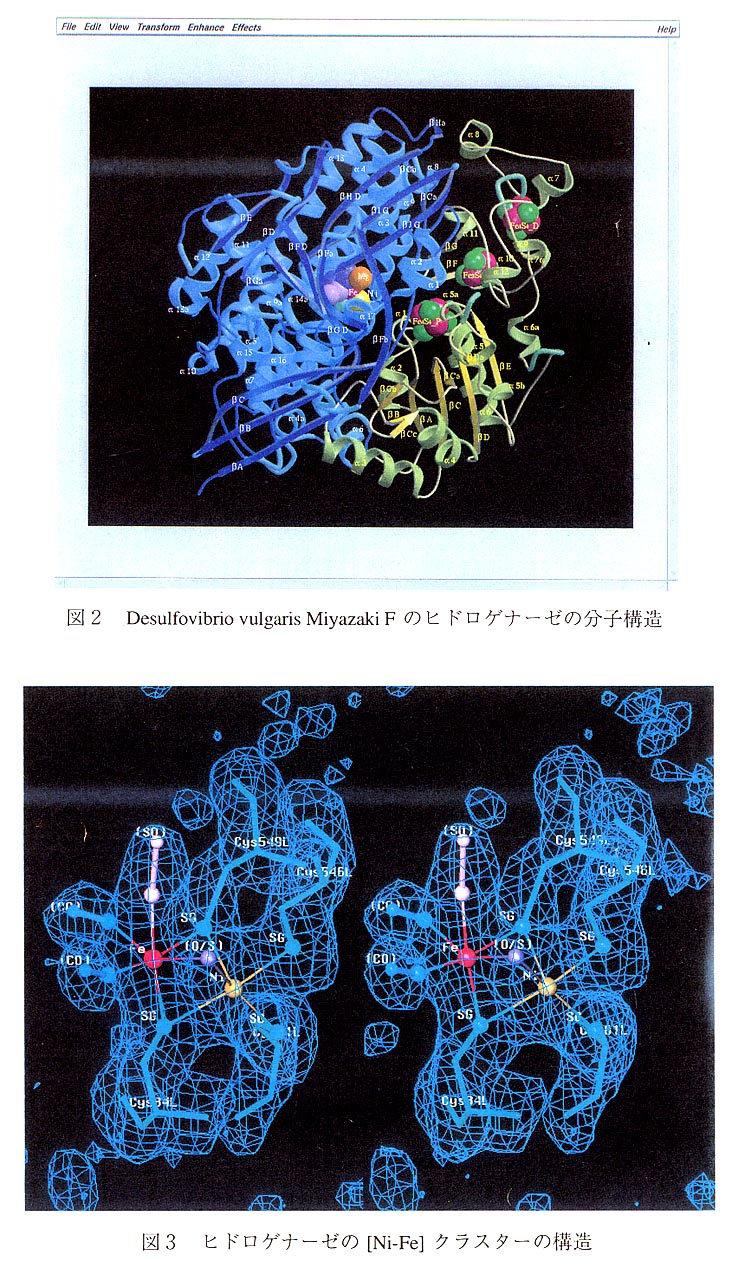
末尾に論文リストを挙げる。フランスのグループとの競合の様子を分かっていただけ ると思う。彼らが扱ったのはDesulfovibrio gigasなどのヒドロゲナーゼであり、われわれのは Desulfovibrio vulgaris Miyazaki F のヒドロゲナーゼであるから両立できると思ったのだが、われわれの論文が日の目を見るまでに手間がかかった。あちらの手がまわっていたのだと思う。われわれのデータはPhotonFactoryでとったものであり、精度も分解能も間違いなく高いという自信がある。全体の構造は似ているが、[Ni-Fe]のサイトの原子配置に違いがあり、あらたに[Mg]のサイトを見いだしたことも重要な知見である。みなさんはどちらに軍配をあげられるでしょうか。ぜひご意見をお聞かせください。
このような活性部位の配置が、酵素としての機能とどのように関連するか、またチトク ロムc3との電子伝達がどのように行われるのかを解明するのが次の課題である。またアデニルサルフェート還元酵素系統名AMP,sulfate:ferrocytochrome c3 oxidoreductase(EC1.8.99.2)は水素、ヒドロゲナーゼ、チトクロムc3などとの協同でSO4-- -SO3--ヘと還 元する酵素である。分子量は約20万でFADと鉄を含むことは知られているが、十分な 情報が得られていない。この酵素の精製・結晶化・構造解析が課題である。
3 チトクロムc'
チトクロムc1の構造と機能に関する研究はアメリカのアリゾナ大学との共同研究であ り、その試料は同大学のProf. Michael A. Cusanovichより入手した。
チトクロムc'は光合成菌などに存在する特異な電子伝達タンパク質であり、中間的な 酸化還元電位(0-125mV)をもつ。ここでは光合成菌Rhodobacter capsula血usのチトクロ ムclの構造解析を行った。これは129個のアミノ酸から成り、酸化還元電位が51mVと 報告されている。このタンパク質の構造研究はWeberとSalemneによって試みられた。 彼らは六方晶系で空問群P62またはP64、格子定数a=b=72.2,c=52.4Åの結晶データを報告しているが構造解析には成功しなっかたようで、その後の報告はない。そこであらためてわれわれはこのチトクロムc'の構造解析に着手した。
以下に略号をまとめて記す。
RCCP Rhodobacter capsulatus cytochrome c'
RMCP Rhodospirmum mohscianum cytochrome c'
RRCP Rhodospirmum rubrum cytochrome c'
RPCP Rhodobacter palustris cytochrome c'
RSCP Rhodobacter sphaeroides cytochrome c'
CVCP Chromatium vinosum cytochrome c'
AXCP Achromobacter xyloseoxidans cytochrome c'
ADCP Alcahgenes denitrficanscc cytochrome c'
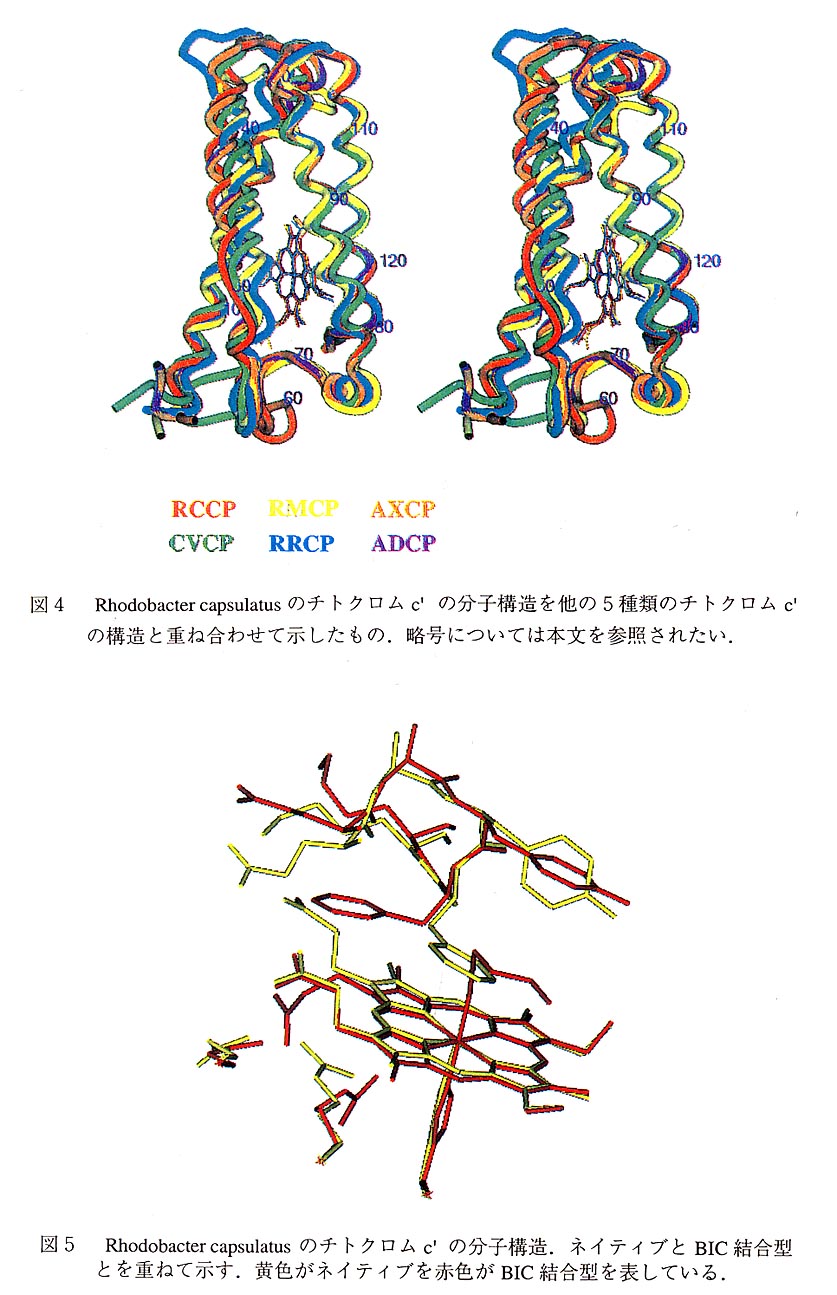
得られた分子構造を図4に示す。これは主鎖をチューブモデルで表現し、これにヘム をワイヤーモデルで付加したものである。立体構造がすでに報告されている他の5個の チトクロムc'の構造を重ね合わせて示した。この図から明らかなようにRMCPや RRCPなどのチトクロムc'の構造と本質的に類似している。
分子は長い4本のαらせんから成る。隣りあう2本のらせんは向きが反対であって、 グロビンによく見られる構造である。2本が対をなしていて、その対の間にへムが存在 する。ランダムコイルがそれらをつなぐ部分とC端およびN端に存在する。アミノ酸配 列の類似性が低いために、一次構造を基礎にしたアラインメントが困難であった。RCCP とCVCPにおいては、2番目のヘリックスがRMCPやRRCPとくらべると6残基だけ早 く始まり、また遅れて終わっていると見ることができる。また2量体構造が特徴である。 2回軸で関係ずけられる構造を示しており、その接触も逆向きのらせんである。これら はらせんの双極子モーメントが相殺するような配置であり、安定な構造である。へムは らせんの中央から少しはずれた位置に存在する。
他のc型チトクロムと同様にシステイン残基Cys118,Cys121によって共有結合でペプ チド鎖に固定されている。ヘムの第5配位子はHis122であるが、第6配位子は特定され ておらず、この分子では近くにPhe14が存在している。このためへム鉄はポルフィリン の平面から0.3Aだけヒスチジンの方へ突き出ている形となっている。CVCPではこの Phe14がTyr16に取り変わっているが、それ以外のチトクロムc'ではメチオニン、ロイ シンになっている。このように第6配位子が芳香族のアミノ酸であるかそうでないかに よって構造が異なっており、一酸化炭素などの小分子との結合に大きな影響をもつことが明らかとなった。
そこでRCCPに配位子を結合させることを試みた。結晶の母液にジチオナイト Na2S2O4を加えると還元型に変わる。こののち、n-nutyl isocyanide(BlC)を加えて結晶を 取り出し、X線解析を行った。回折実験は当研究室に設置したイメージングプレート回 折装置を用いた。プログラムDENZOを用いてデータを処理した。XPLORを使用して構 造を解析した。
得られた構造をネイティブとBlC結合型とを重ねて図5に示す。変化の大きいへム近 傍のみを示す。黄色がネイティブを赤色がBlC結合型を表している。また水素結合のネ ットワークも大きく変化した。それを図6に示した。
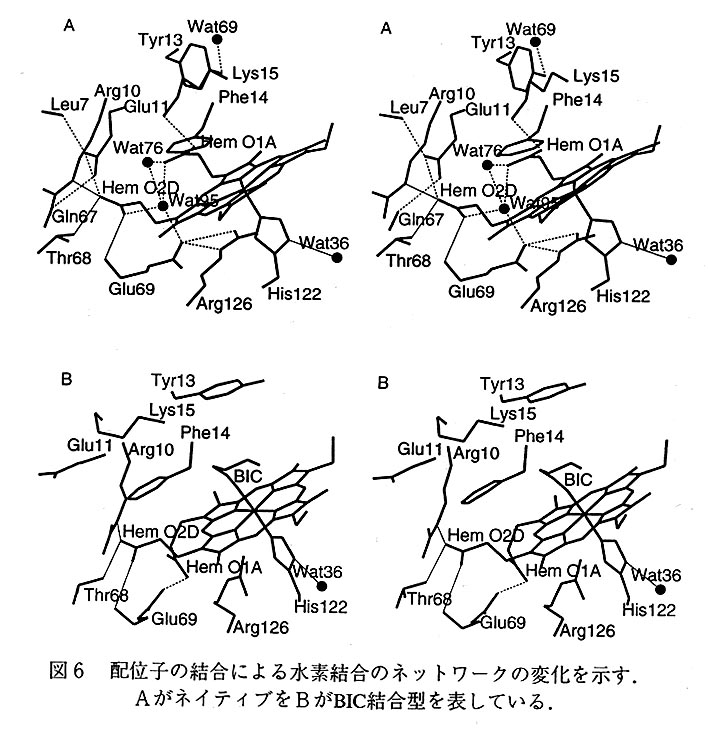
チトクロムc'において配位子が結合したことによるこのような構造変化が明確に示さ れた最初の例である。BlCを結合させる空間を作るためにいくつかの残基が大きく動いて いる。Tyr13の芳香族環はその最初の位置から約90度回転している。Phe14の芳香族 環はCα-Cβ結合のまわりに140度、またCβ-Cγ結合のまわりに63度回転しており、 もとの位置から大きく動いている。その動きが波及してGlu11の側鎖とへムのピロール 環Aのプロピオン酸基がphe14の芳香族環を避ける方向へこれも大きく動いている。そ の動きはPhe14の場合と同様に単結合のまわりの回転によって達成されている。へムの ピロール環Aのプロピオン酸基の移動はArg126に影響を及ぼすことになりそのグアニジ ウム面はもとの位置とは垂直になっている。またこのため第5配位子であるHis122のイ ミダゾール環もわずかに動いている。そのほか周辺のヘリックスの位置にも少し影響が 見られる。タンパク質が生理的な機能を果たす際には活性部位において、基質などとの 相互作用のため大きな動きを示すと考えられているが、それをX線解析により捕足した例 は少ない。BlCは生理的な配位子ではないが、そのモデルと見なすことができる物質であ り、この研究成果はタンパク質が生理的な機能を果たす際に見せる構造変化を捕らえたものと言えよう。
このような側鎖の動きは当然のことながら水素結合のネットワークの組み替えをもたらしている。図6のAがネイティブをBがBlC結合型を表している。配位の前後において変 化を起こした水素結合は破線で示し、変化がなく保存されている水素結合は実線で示してある。また配位によって結合していた水分子の1部が失われている。水素結合の組み替 えはプロトン輸送の可能性を示すものと見ることができる。とくに酸素分子が結合する ことによるヘムのピロール環Aのプロピオン酸基の移動が水素結合の組み替えを引き起こ し、それ故プロトン輸送につながるということは、l酵素などの生理作用を考察する上で 貴重な示唆を含んでいると考えられる。
4 むすび
長い期間やってきたが、そのなかでふたつの研究を紹介させていただいた。研究室 の総力を挙げた研究であった。ヒドロゲナーゼには10年かかった。樋口芳樹博士らの 仕事である。チトクロムc'は2年でDr Tahir Tahirovらの仕事である。最初に書いたよう にイオウの循環という点で硫酸還元菌と光合成細菌はつながっていると言えるが、酵素やタンパク質のレベルでは程遠い課題である。構造解析には長い期間が必要でありなかな か大きな仕事にならないが、揺るぎのない構造は重要なデータとして生きて行くことであろう。
[Hydrogenase]
Y.Higuchi, N.Yasuoka, M.Kakudo, Y.Katsube, T.Yagi, H.Inokuchi
Single Crystals of Hydrogenase from Desulfovibrio vulgaris Miyazaki F
Journal of Biological Chemistry Vol.262, 2823- (1987)
Y.Higuchi, T.Okamoto, K.Fujimoto, S.Misaki, Y.Morimoto and N.Yasuoka
Location of Active Sites of NiFe Hydrogenase determined by the Combination of Multiple
Isomorphous Replacement and Multiwavelength Anomalous Diftaction Methods
Acta Crystallographica. D50, 781-785. (1994)
Y Higuchi, T. Okamoto, and N. Yasuoka
The heterogeneity in a protein crystal revealed by synchrotron radiation
J. Crystal Growth, 1996, 168, 99-105
Yoshiki Higuchi, Tatsuhiko Yagi and Noritake Yasuoka,
Unusual ligand structure inNi-Fe active center abd an additional Mg site in hydrogenase revealed by high resolution X-ray structure analysis
Structure, 5, 1671-1680 (1997)
Anne Volbeda, Marie-Helene Charon, Claude Piras, E. Claude Hatchikian, Michel Frey & C.
Fontecilla-Camps, Crystal structure of the nickel-iron hydrogenase from Desulfovibrio gigas
Nature, 373, 580-587 (1995)
Anne Volbeda, Elsa Garcin, Claude Piras, Antonio I. de Lacey, Victor M. Fernandez, E. Claude Hatchikian, Michel Frey & Juan Claude Fontecilla-Camps,
Structure of the [NiFe] Hydrogenase Active Site: Evidence for Biologically Uncomnlon Fe Ligands
J. Amer. Chem. Soc., I 18, 51, 12989-12996 (1996)
Yael Montet, Patricia Amara, Anne Volbeda, Xavier Vernede, E. Claude Hatchikian, Martin J. Field, Michel Frey & C. Fontecilla-Camps,
Gas access to the active site of Ni-Fe hydrogenases probed by X-ray crystallography and molecular dynamics
nature structure biology, 4, 523-526 (1997)
[Cytochrome c']
Y. Higuchi, Y. Okama, T. Kanda, S. Misaki, N. Yasuoka, T. E. Meyer and M.A. Cusanovich
Crystallization and preliminary X-ray study of a new crystal from of cytochrome c' from Rhodobacter capsulatus
Acta Crystallographica, D52, 199-200 (1996)
T. H. Tahirov, S. Misaki, T. E. Meyer, M. A. Cusanovich, Y. Higuchi, and N. Yasuoka
Concerted movement of side chains in the haem vicinity observed on ligand binding in cytochrome c' from Rlrodobacter capsulatus,
nature structural biology, 3, (5), 459-464 (1996)
T. H. Tahirov, S. Misaki, T. E. Meyer, M. A. Cusanovich, Y. Higuchi, and N.Yasuoka
High-resolution Crystal Structures of Two Polymorphs of Cytochrome c' from the
Purple Phototrophic Bacterium Rllodobacter capsulatus,
J. of Molecular Biology, 259,(3), 467-479 (1996)
T. H. Tahirov, S. Misaki, T. E. Meyer, M. A. Cusanovich, Y. Higuchi, and N. Yasuoka
Crystal structure of cytochrome c' from Rhodobacter capsulatus strain St. Louis: An unusual molecule association induced by bridging Zn ions
Acta Crystallographica, D53, 658-664 (1997)