1. はじめに
抗血液凝固活性をもつ蛇毒由来タンパク質として、現在までにKX因子に結含する もの(IX-bp)、X因子に結合するもの(X-bp)、IX因子とX因子のどちらにも結 合するもの(IX/X-bp)等が見いだされており、それぞれのアミノ酸配列が決定 されている1-3)。これらのタンパク質はアミノ酸配列が互いによく似たA鎖(129残基)とB鎖(123残基)からなるへテロ2量体であり、両鎖はジスルフィド 結合により結ばれている。各鎖は、C型レクチンの糖鎖認識ドメイン(C型CRD) のアミノ酸配列と相同性があることから、DrickamerによってC型レクチンブアミ リーの第Ⅶグループに分類されている4)。ところが、このタンパク質は糖鎖を特異的に認識するいわゆるレク:チン活性をもたない。このようにC型CRDと相同性 の高いアミノ酸配列をもちながら、カルシウム存在下において血液凝固因子と結合 するというレクチンとは全く異なる生理機能を表すメカニズムを立体構造の立場か ら明らかにするためにX線結晶解析を行った。
構造既知のC型レクチンであるマンノース結合蛋白質(MBP)5)と今回解析し たIX/X-bpとを比較したところ、中央ループのフォールディングが両者で大きく 異なることか見いだされ、これによって機能の違いを説明できるという興味深い結 果を得ることができた6)。
2. 実験
1)結晶化及び放射光を利用したX線データの測定
今までに結晶化されている血液凝固因子結合タンパク質はハブ毒由来のIX-bpと Dm/x-bpである。それぞれのタンパク質の結晶化条件と結目日目学的データを表1に 示す。IX-bpとIX/X-bpとの間のアミノ酸配列の違いは、A鎖において19残基、 B鎖は同一であることから両分子はよく似た立体構造をもつと考えられるので、一 方の構造が解析できれば、他方の構造は容易に解けると思われる。実験を始めた当 初、XX/X-bp結晶については分解能の高いX線データが得られない状況であった 7)。一方、IX-bpを用いて作製した結晶からは3Åを越える回折像が得られたので、先ずIX-bp結晶の方の解析から始めた。
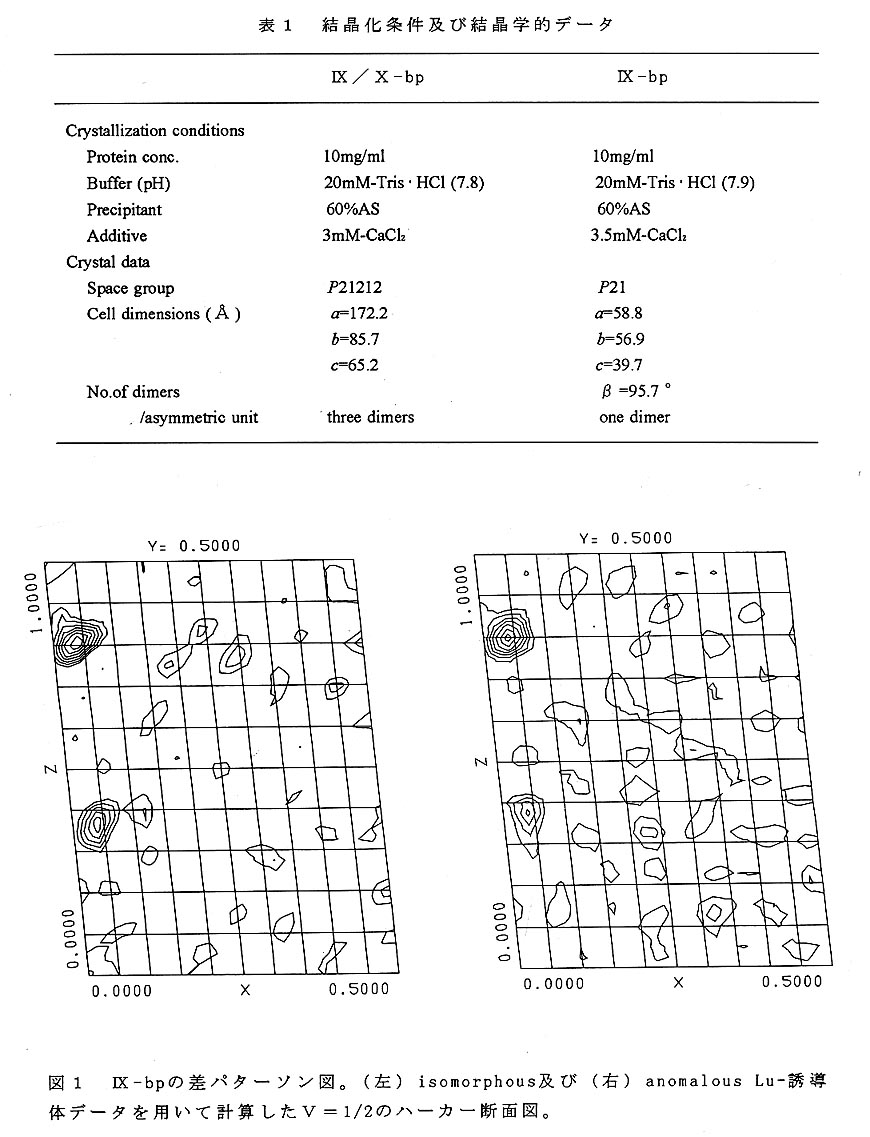
回折強度は高エネルギー加速器研究機構の放射光施設(PF)のBL6A2にお いて測定した。また、実験の後半にはTARAビームラインBL6Bを併用してX 線測定を行った。波長1.00ÅのX線を用いて、Native結晶及びランタナイド重原子 誘導体結晶についてそれぞれのデータセットを収集した。ランタナイド族重原子と しては波長1.00Åにおいて異常分散効果の大きいルテチウム(Lu)を使用し、バ イフット対の測定を行った。PHASESを用いて計算したiso及びanomalous差パ ターソン関数のハーカー面を図1に示す。この図に現れた2つのピーク位置とその クロスベクトルに相当する2つの顕著なピークの位置から2つの重原子座標を求め ることができた。これらのピークはanomalous差パターソン図においても観測ざれ、 異常分散効果の有効性が示唆された。

2)構造解析
ランタナイド族以外の有効な重原子誘導体結晶が得られなかったため、Lu原子 の異常分散を利用して重原子パラメータの精密化を行い、Sl RAS法に従って位 相計算を行った。4.0Å分解能データを用いて計算した電子密度図には2量体を 示すIX-bp分子の輪郭が明瞭に認められた。3.0Å電子密度図においては各モノマ 一中のαヘリックスやβ-ストランド等に相当する連続したピークが認められた が、分子全体のトレースは困難であった。次に、同じランタナイド族のSm誘導体 のデータを加えて電子密度の計算を行い、さらにsolvent flattening法により位相 を改良し、2.8Åにまで拡張した電子密度図においては、側鎖を含めた主鎖のト レースを比較的スムーズに行うことができた。しかし、A及びB鎖間のジスルフイ ド結合位置の少し手前から始まる長い中央ループについては、電子密度が存在する にもかかわらず、両鎖において整合性のあるモデルを構築することができなかった。 問題の中央ループの解釈は、種々の位相計算法や電子密度の改良法等を試みたが困 難であった。解釈できた部分の主鎖iモデルのA鎖あるいはB鎖の上に構造既知のM BPのモデルを重ね合わせることができた。各鎖とMBPとの間のアミノ酸配列の ホモロジーは20%足らずと低いにもかかわらず、主鎖フォールドは保存されてい ることがこの段階で判明した。
他方、平行して進めていたIX/X-bp結晶化実験で、2.5Å分解能の回折像を与 える結晶(表1)が得られ、Native及びLu重原子誘導体結晶の強度データを収集 した。差パターソン図より、先ず3個の重原子位置が決まり、残りの重原子は差フ ーリエ図より求めることができ、結局合計6個の重原子が見いだされた。格子定数 の大きさから2または3分子が非対称単位に存在すると考えられていたが、これに よって3分子であることが明らかになり、IX-bpの解析で求められた重原子間距離 を参考にして、2個づつの重原子の組を3個のIX/X-bp分子に帰属させることが できた。2.6Å分解能データを用いて重原子パラメータの精密化をMLPARE により行い、10サイクル後の平均のfigure of meritは0.49となった。また、 centric及びacentric反射データのCullis R因子はそれぞれ0.52,0.64であ り、anomalousデータのCullis R因子は0.83であった。位相の改善には、DMに 含まれているsolvent flatteningとhistogram matchingを併用し、溶媒領域を50 %として4.0Å分解能から始めて100サイクルの繰り返しにより2.5Å分解能 まで拡張し、Rfree値は0.53から0.29に下げることができた。この位相で計算 したフーリエ図の上には、非対称単位中の3個のIX/X-bp分子を示す電子密度が 明瞭に現れ、それぞれの場所にIX-bpの解釈済み部分の主鎖モデルを、2個の重原 子位置を目安にして重ね合わせることができた。
3)NCS平均化による電子密度の改良
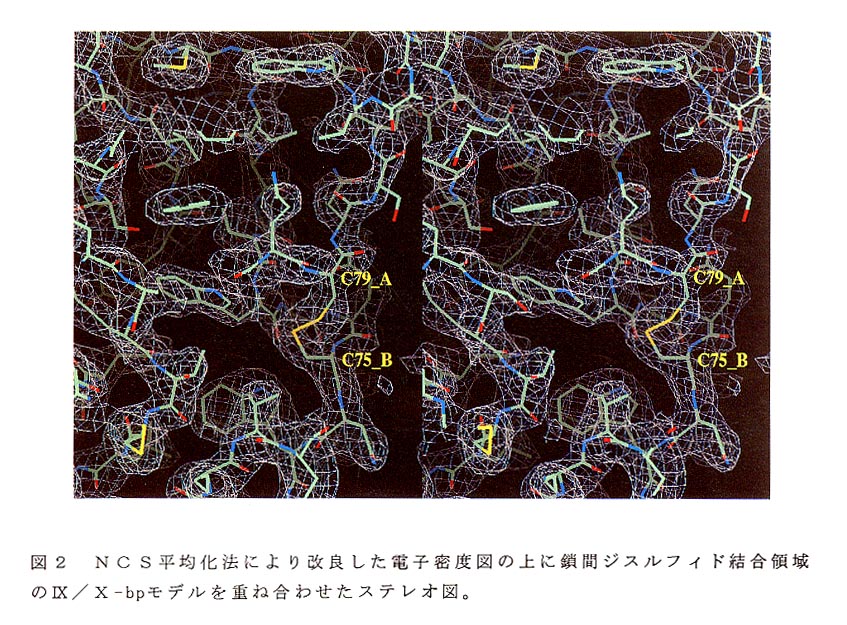
非対称単位中の3個のIX/X-bp分子の電子密度を平均化(NCS平均化)する ことにより電子密度図の改良を行った。先ず3分子の間を関係づける非結晶学的対 称マトリツクスを決定した。そのためにsolvent flatteningとhistogram matching 法により改良した電子密度図の上に組み立てた信頼度の高い4本のα一へリックス のCα座標と2個の重原子座標を各分子より選び出しマトリックスを計算した。適 正なマスクの作成には、山下栄樹博士が紹介したPHASESのMAPVl EWを 使う方法(構造生物Vol.2No.2,27-32,1996)に従って作成した。このマスクとマ トリックスによるNCS平均化法をDMにより100サイクル計算し、Rfree値が 0.27、非結晶学的対称の関係にある3分子の間の相関係数がそれぞれ0.88, 0.88,087となった。改良された電子密度図は非常に明瞭で、主鎖や側鎖を 示す特徴的な電子雲が明確になった。これによって問題の中央ループのトレースが 可能になった。図2にこの領域の電子密度図と分子モデルを重ね合わせたステレオ 図を示す。これまではMBPの構造を参考にしたために中央のループは本体側に折 り返すものだと考え、Cys79Cys75の鎖間ジスルフイド結合を主鎖の電子密度 と間違えて解釈した。しかし、実際の構造は図3Aの全体モデルから明らかなよう に、両鎖の中央ループは本体から外側に向かい、互いに隣のサブユニットに深く入 り込んでいた。これについては後述する。改良された電子密度図を用いて、側鎖を 含めた分子全体のモデルを構築し、精密化の出発モデルとし、XPLORマニュア ルに従って構造の精密化を行った。水分子146個を加えた最終モデルのR値-及び Rfree値は6.0-2.5Å分解能の反射データに対して、それぞれ17.8%、24.8%であった6)。
IX-bpについてもIX/X-bpと同様なモデルを用いて構造の精密化を進めている。
3. IX/X-bpの立体構造
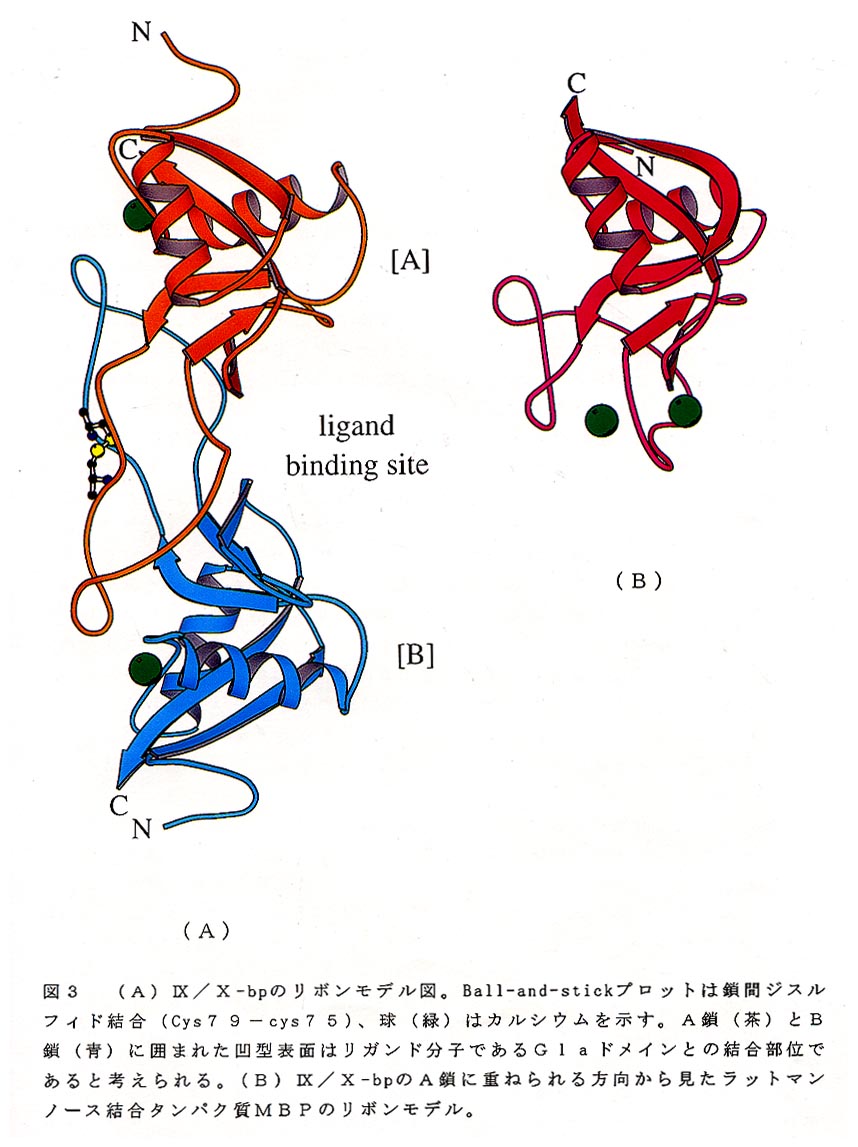
A鎖(サブユニットA)とB鎖(サブユニットB)は、分子の長軸にほぼ垂直な 方向にある偽似2回軸によって関係づけられる2量体を構成している(図3A)。 カルシウムイオンは各鎖に1個づつ存在する。これらの位置はランタナイド族重原 子の位置に相当し、重原子ソーキングにより置換することができる。各鎖の中央ル ープは、それぞれのサブユニットの外側に大きく突出して隣のサブユニットの本体 部分と結合し安定な2量体を構成している。図3BはMBPを図3AのA鎖に重ね られる方向から見たものであるが、MBPでは中央のループが分子の内側に折り畳 まれており、皿X/X-bpの外側に突出したA鎖のループと明確に異なる。ループ以 外の部分の主鎖フオールディングについてはA鎖とMBPはよく類似しており、両 者を重ね含わせた時のCαの位置の差のrms値は1.2Åである。両者のアミノ 酸配列のホモロジーは15%と低いが、MBPの構造解析で見いだされたC型CR Dフオールドが中央ループを除き保存されている。以上の点は、B鎖とMBPとを 比較した場合においても同様である。ところで、再度図3Aを注意深く眺めてみる と、A鎖の本体部分とB鎖の中央ループを組み合わせるとMBPのC型CRDフオ ールド(図3B)を再現することができる。すなわち各鎖間で中央ループを交換す ることによって、もとのC型レクチンの基本骨格であるC型CRDフオールドが作 られている。このことはMBPの構造をIX/X-bpの仮想的モノマーと見なせぱ、 2量化に際してループドメインスワッピングが起きたと考えることができる。ド メインスワッピングは活性調節のための2量化、3量化あるいは多量化機構の一つ としてEisenbergらによって提案されたものである8)。
C型レクチンの活性発現にはカルシウムが必須であるが、MBPに結合している 2個のカルシウムの一つ(図3Bの右側のもの)はC型レクチンに共通に存在し、 実際に糖鎖の認識に直接関与している。IX/X-bpの構造解析結果では、これらの カルシウム結合部位に相当する場所にはカルシウムは認められなかった。これは結 合サイトの中央ループに存在するペプチド鎖が、ドメインスワッピングによって大 きくコンフオメーション変化し、カルシウム結合には不適切なジオメトリーとなっ たためである。その結果、レクチン活性が喪失したものと考えられる。新しいカル シウム結合サイトは図3Aに見られるように2つのヘリックスを結ぶループ付近に 存在し、構造の安定化に寄与していると思われる9)。
さて、IX/X-bpは血液凝固因子のN末端領域のGI aドメインと結合すること が知られている。IX/X-bp側の結合サイトの候補はドメインスワッピングによる 2量化によって生じた、A鎖とB鎖に囲まれた凹型表面である(図3A)。その根 拠として次の3点が拳げられる。1)GI aドメインのサイズと形状は候補結合部 位の凹型表面にフイットする、2)凹型表面の中央部に塩基性アミノ酸で作られる パツチがあり、マイナス荷電に富むGI aドメインとの間でソルトブリッジを介し た相互作用が可能である、3)これらの塩基性アミノ酸は、同様にGI aドメイン に結合するIX-bpやX-bpにおいてもよく保存されている。
最近、蛇毒由来へテロ2量体タンパク質フアミリー中でvon Willebrand factor や血小板膜表面のgpI bなど様々なタンパク質をリガンドとするものが見つかり、 機能が多様であることがわかってきた。これらのタンパク質の構造はIX/X-bpと 同様にドメインスワッピングによってつくられたC型CRDの2量体であると考え られる。おそらく、新しい機能を獲得するために、進化の過程で、C型CRDとい う構造単位の合理的且つ有効な利用が行われたものと推察することができる。
4.おわりに
この研究は、農業生物資源研究所の藤本瑞研究員、小泉美香研究員、狩野広美博 士、明治薬科大学の森田隆司教授、阿刀田英子講師との共同研究である。構造解析 のNCS平均化について助言いただいた阪大蛋白研月原研究室の山下栄樹博士に感 謝いたします。また、放射光の利用にあたっては大変お世話になった坂部知平博士、 中川敦史博士、渡辺信久博士、鈴木守博士に感謝いたします。
文献