はじめに
亜鉛は、生体必須金属イオンとして鉄についで多く生体内に存在し、そのほとんど が「亜鉛酵素」として働く。亜鉛プロテアーゼはその代表的なものである。亜鉛プロテアーゼはぺプチド結合を加水分解して、細胞の育成、生合成に必要なアミノ酸の供給に関係するほか、細胞の代謝などに関与する酵素である。この亜鉛プロテアーゼの作用機構については、蛋白質の立体構造をもとに酵素化学的研究およびモデル研究との両方からのアプローチがなされており、最近特にめざましい進歩を遂げている。このような背景をもとに、本研究では酵素学的および結晶学的手法を用いて亜鉛プロテアーゼの作用機構を詳細に考察することを目的とした。
これまで多く研究されてきた亜鉛プロテアーゼは、分子量約20,000から50,000程度のものであった。本研究では、まず分子量15,000の小型亜鉛プロテアーゼである放線菌Streptomyces caespitosusが産出する亜鉛プロテアーゼ(ScNP)の酵素学的特性を通常の方法で明らかにするとともに、X線結晶構造解析法によりその立体構造を解明した。しかしながら、得られた構造は時間的、空間的に平均化されたものであり、その構造から反応機構を類推することは容易ではない。そこで、さらに詳細に反応機構を考察するための結晶学的手法の開発と適用を試みた。
本研究で取り上げた新規な結晶学的手法は、1)ラウエ法による時間分割構造解析と2)超精密構造解析である。ラウエ法は、結晶中の酵素反応を見る動的構造解析の手段として、現在世界中で開発が進んでいる。本研究では、寿命の短い反応中間体の構造を見る時間分割構造解析の為のデータ収集法を確立した。また、通常の蛋白質結晶構造解析では、水素原子の位置を特定することは不可能であるが、結晶の操作を工夫することによって、有機分子結晶と同等の分解能までのX線回折強度データを収集することに成功した。
1. 小型亜鉛プロテアーゼの酵素学的特性とその分類
放線菌Streptomyces caespitosusが生産する亜鉛プロテアーゼ(ScNP)は132個のアミノ酸からなり、これまでに発見された亜鉛プロテアーゼのうち最も小型の亜鉛プロテアーゼである。そこで、本研究ではScNPの基質特異性および最適反応条件を決定し、活性中心の亜鉛イオンを他の金属イオン(Cd2+,Mn2+およびCo2+に置換したときの活性の変化を測定した。
1-1 ScNPの精製および最適反応条件の決定
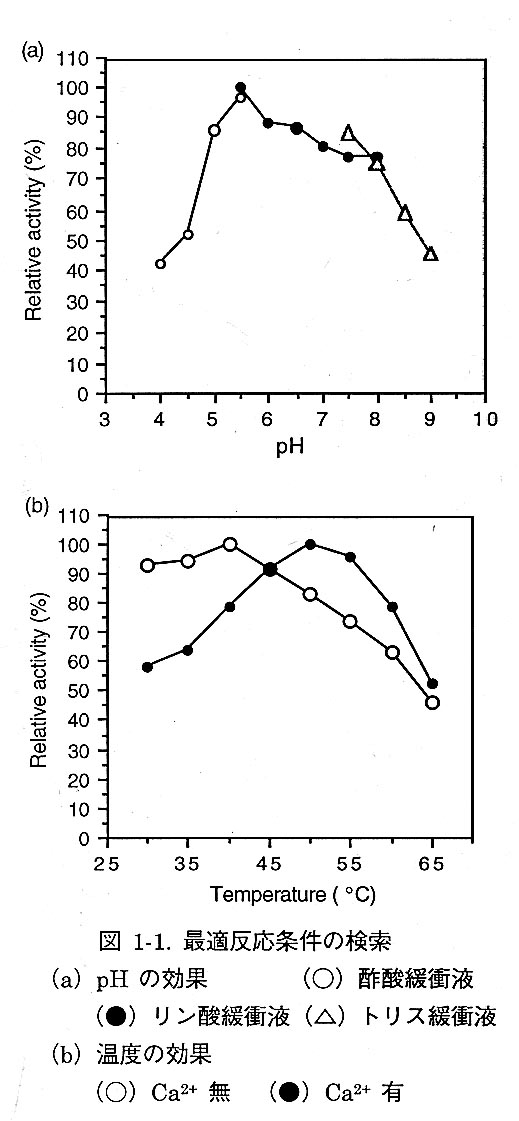
ScNPは工業的目的で見い出された酵素である。本研究のための精製は、陽イオン交換クロマトグラフィー、分子ふるいクロマトグラフィーを用いて行った。このようにして得られたScNPは電気泳動的に純粋なものであった。プロテアーゼ活性は通常カゼイン消化法で測定する。ScNPの最適条件を決定する為、アゾカセインを基質とし、温度、pHを変化させてプロテアーゼ活性を測定したところ、pH6.0、温度40℃のとき最も活性が高くなることがわかった。また、カルシウムイオン存在下では、最適温度が約10℃。上昇し、約50℃で活性が最大になることも併せて明らかにした。さらに、温度変化にともなうCDスペクトルの測定によりScNPの融解温度1血11を67.1℃と決定した。

1-2 基質特異性の確認および金属置換体酵素の活性測定
還元型インスリンB鎖を基質としてScNPによる蛋白質分解特性を決定した。分解物を HPLCにより分取し、各ピークに相当するペプチドの配列を解析した結果、ScNPはフェニルアラニンやチロシン等の芳香族残基のN末端側を特異的に加水分解することが示唆された。最後に、EDTAを作用させることにより調製したアポ酵素に、透析により他の金属イオンを導入して金属置換体酵素を調製した。金属置換体酵素の活性を天然型酵素の活性と比較したところ、マンガンイオンを導入した酵素が最も高い活性を示した。一方、耐熱性プロテアーゼとして知られ、その立体構造も明らかになっているサーモライシンの場合、同様の実験の結果マンガン置換酵素の活性が低いという結果が報告されている。なぜ、金属置換の効果がサーモライシンとScNPで著しく異なるのかを明らかにするためには、金属置換体酵素の結晶構造解析を行う必要があると恩われる。
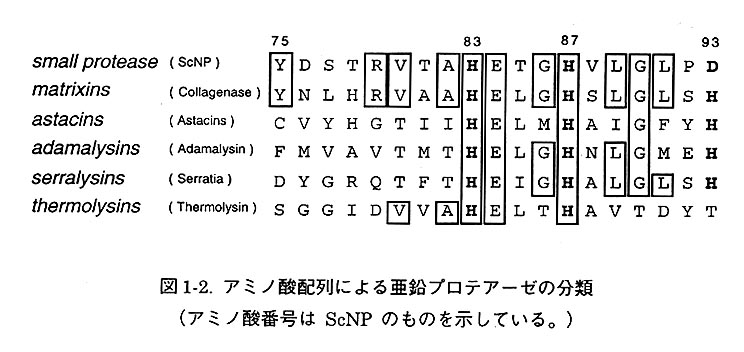
1-3 亜鉛プロテアーゼのアミノ酸配列をもとにした分類
亜鉛プロテアーゼはアミノ酸配列から matrixins, astacins, adamalysins, serralysins, thermolysinsの5つのグループに分類されていた(図1-2)。しかしながら、本研究で用いたScNPおよび放線菌Streptomyces sp. strain C5の産出する亜鉛プロテアーゼ(SnpA)のアミノ酸配列中には亜鉛プロテアーゼに必須のHEXXH配列は存在するが、3番目の配位子であるはずのヒスチジンおよびグルタミン酸が存在しない。すなわち、ScNPおよぴSnpAはこれまでに分類されていた5つのグループに属さないことが示唆される。ScNPおよびSnpAはこれまでにない新しいファミリーを構成していると提唱できる。そこで、この新しい「小型プロテアーゼファミリー」の3番目の配位子を決定することが重要であった。グルタミン酸、ヒスチジンを3番目の配位子としないファミリーの配位子を明らかにするとともに、反応機構を解明するためにScNPの結晶構造解析に取り組んだ。
2. 小型亜鉛プロテアーゼの結晶学的研究
亜鉛プロテアーゼの反応機構を解明する目的で、ScNPの結晶化を行い、結晶学的データを決定した。次に、多重同型置換法によりScNPの立体構造を1.6Å分解能で明らかにした。
2-1 ScNPの結晶化およびX線データの収集
ScNPの結晶化はScNP溶液に沈殿剤としてアセトンを加えて4℃に静置するバッチ法で行 い、約一ケ月後にエッヂのはっきりした柱状の結晶が得られた。結晶学的データを決定するためプレセッション写真を撮影した。その際、沈殿剤が揮発性の高いアセトンであるため結晶の安定性が悪くなるので、沈殿剤を50%MPD(2-メチル2,4-ペンタンジオール)に置換した結晶を用いた。プレセッション写真から空問群がP212121、格子定数がa=55.21,b=55.27,c=37.60Åであることが判った。次に、ネイティブ結晶と重原子誘導体結晶の回折強度データを理学4軸自動回折計を用いて測定した。線源には理学回転対陰極型X線発生装置からのCuKα線をNiフィルターで単色化して用い、ωスキャン法で回折強度を測定した。データ測定中のX線による結晶の損傷は少なく、すべてのデータセットは1つの結晶で測定できた。測定したデータは、吸収補正、減衰補正等を行い、各重原子誘導体結晶の回折強度データをネイティブ結晶に対してスケーリングした。測定に用いた重原子誘導体結晶は6種の重原子試薬(塩化水銀、メチル塩化水銀、酢酸鉛、硝酸ウラニル、塩化イリジウム、塩化白金)溶液にネイティブ結晶をソーキングして調製した。
2-2 初期位相の決定および分子モデルの作成
構造解析は6種類の重原子誘導体を用いて多重同型置換法(MIR法)により行った。構造解析計算はすべて、大阪大学蛋白質研究所、蛋白質工学基礎研究センターの大型計算機を用いた。まず、蛋白質結晶の位相を得るために(F(PH)-F(P))2を係数とするパターソン関数を計算した。その結果、比較的容易にメチル塩化水銀の位置が特定でき、得られた位相角を用いて差フーリエによる他の誘導体中の重原子位置の確認と、最小自乗法による重原子位置の精密化を行った。最終的に位相角の確からしさの指標である figure of meritは0.81と非常に良い値となった。そこで、MIR法で得た位相角を用いて電子密度図を計算した。まず、6Å分解能で分子境界を決定し、透明シートを用いてミニマップを作成した。主鎖の隣接するCα炭素の間隔が3.8Åであること、およびトリプトファンやチロシン、ヒスチジン等の大きな側鎖が電子密度に対応するように解釈していき、2.5Å分解能で主鎖のトレースを行った。次に、ミニマップ上で作成した主鎖構造をもとに大阪大学蛋白質研究所、蛋白質工学基礎研究センターのグラフィックスシステムを用いて全体モデルの構築を行った。その際、3本のαヘリックスと4本のβ鎖からなるβシートが確認された。
2-3 構造精密化
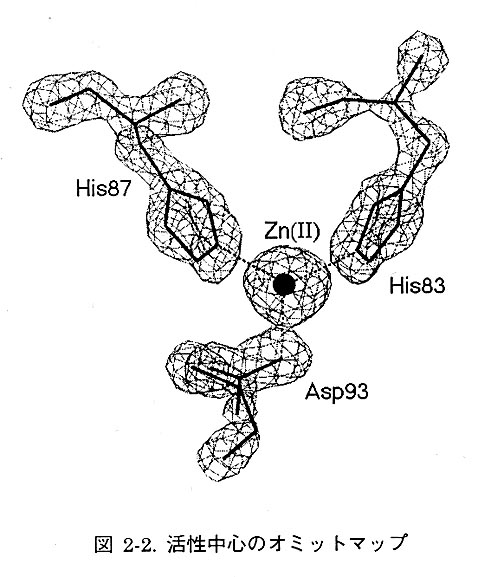
4軸自動回折計を用いて測定した1.5Å分解能までの良質のネイティブデータを用いて、モデルの精密化を行った。精密化計算プログラムX-PLORによる計算と、MIRマップによるモデル修正を繰返し行い、結晶学的信頼度因子R値は28%となった。しかし、MIRマップで不明瞭であったループ部分とN末端部分は、この時点で2Fo-Fcマップを用いても確認できず、MIR法で求めた位相の改良を行うことにした。プログラムSQUASHを用いて数サイクルの溶媒領域平滑化(Solvent flattening)を行ったところ、分子表面にあったループとN末端の電子密度が改良された。コンピューターグラフィックスでモデルを修正したのち、再びX-PLORで新しい位相の制限を加えて計算したところ、R値は25%になった。2Fo-Fcを係数とするオミットマップによる修正とPROLSQによる精密化計算を繰返し、差フーリエによる溶媒水分子の検索の結果、1.6Å分解能で水分子132個を加えてR値は16.6%となった。図2-2に活性中心残基の電子密度図を示す。亜鉛の配位子である2つのヒスチジンとアスパラギン酸の電子密度を示している。4番目の配位子である水分子の方向からみた電子密度である。きれいな正4面体配位構造をとっていることがわかる。
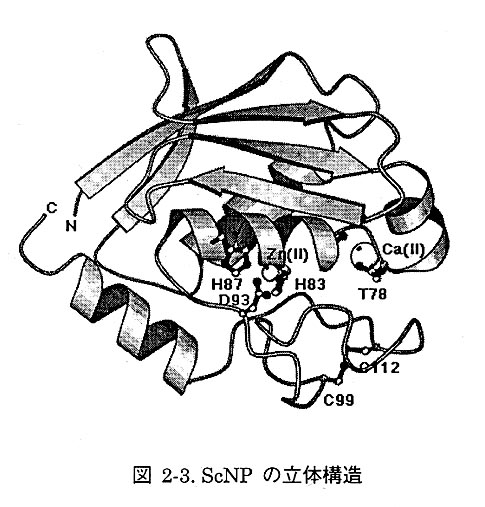
2-4 ScNPの立体構造
得られたScNPの構造は図2・3に示すとおり、コンパクトな球状をしている。N末端からP鎖 がのびており、1本目と2本目のβ鎖の問に存在する1本目のαへリックスをβシートが包み込む ような構造をしている。このトポロジーは「open sandwich topology」と呼ばれ、エンド型亜鉛プ ロテアーゼによく見られる構造モチーフである。つぎに、短い2本目のαへリックスを間にはさん で分子の中心を貫く3本目のαヘリックスが存在する。この3本目のαへリックスには亜鉛の配位 子となる2つのヒスチジンを含む亜鉛プロテアーゼ特有のアミノ酸配列(HEXXH)が存在している。3本目のαへリックスはグリシン残基によりその主鎖の向きを変え、2次構造をとらない領域へと続いており、2次構造をとらない部 分はジスルフィド結合により、構造が安 定化されている。最後に、C末端に向け て長い4本目のαヘリックスが存在して いる。亜鉛原子は分子の中心に存在する クレフトの中央にあり、このクレフトが 活性中心であることがわかる。クレフト 内にはScNPのアミノ酸配列に特徴的な 3つのグリシン残基により形成される基 質認識部位が存在する。また、カルシウ ムイオンがl本目のαヘリックスと3本 目のαヘリックスの間に位置し、水素結 合により分子全体を安定化しているこ とがわかった。このカルジウムイオンの 役割は、先に決定したカルシウムイオン が存在すると最適pHが約10℃上昇 するという酵素学的データとよく一致している。
3. 亜鉛プロテアーゼの構造と反応機構
本研究で得られたScNPの立体構造と、これまでに最もよく研究されきた好熱菌 Bacillus thermoproteolyticusが産出する亜鉛プロテアーゼ(サーモライシン)との立体構造の比較を行った。また、モデル化合物の研究から提唱されているサーモライシンの反応機構をもとにScNPの反応機構を類推し、とりうる反応中間体について考察をおこなった。
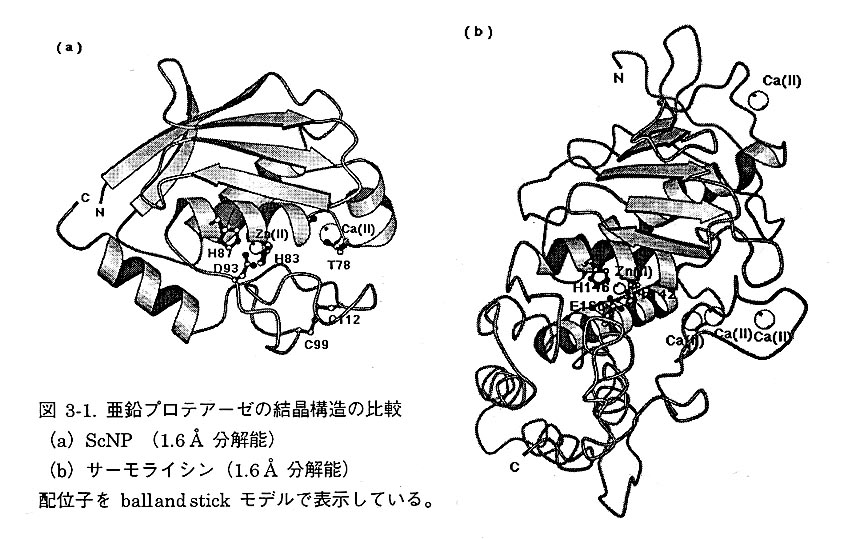
3-1 亜鉛プロテアーゼの全体構造の比較
ScNPはこれまでに研究された亜鉛プロテアーゼのなかで、アミノ酸残基数が少なく分子量が最も小さいエンド型亜鉛プロテアーゼである。サーモライシンはロイシン、イソロイシン、フェニルアラニンなど疎水性のかさ高い側鎖をもつアミノ酸のN末端側を加水分解する亜鉛プロテアーゼである。分子量は37,500、316個のアミノ酸と亜鉛およびカルシウムイオンで構成されている。サーモライシンの立体構造はMatthewsらにより1.6Å分解能で明らかにされている。本研究で得られたScNPの構造をサーモライシンの構造と比較したところ、全体のトポロジーが類似している。したがって、ScNPの分子量が小さいのはループ部分が短いことおよび2次構造をとらない部分が少ないことから生じていることがわかった(図3-1)。すなわち、ScNPの立体構造の多くは亜鉛プロテアーゼに必須の部分から構成されているといえる。
3-2 亜鉛プロテアーゼにおいて提唱されている反応機構
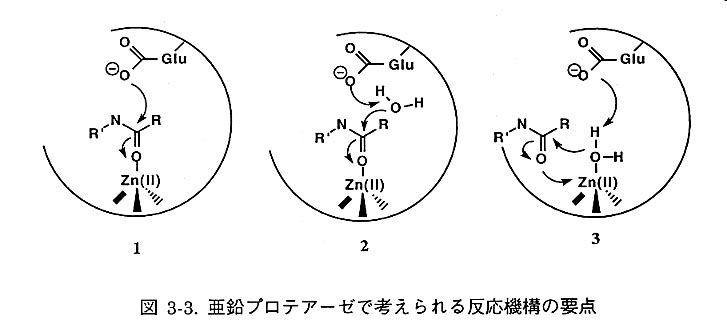
亜鉛プロテアーゼの活性中心には配位子の水と水素結合したグルタミン酸 が保存されていることをふまえて、酵素化学的研究およびモデル研究から、一般に図3-3のような3つの反応機構が提唱されている。1はグルタミン酸が直接基質のカルボニル炭素を求核攻撃する機構、2は水が求核剤として働く機構、3は亜鉛に配位した水がグルタミン酸の作用によりZn-OHとなり、それがカルボニル炭素を求核攻撃する機構である。
3-4 ScNPで考えられる反応機構
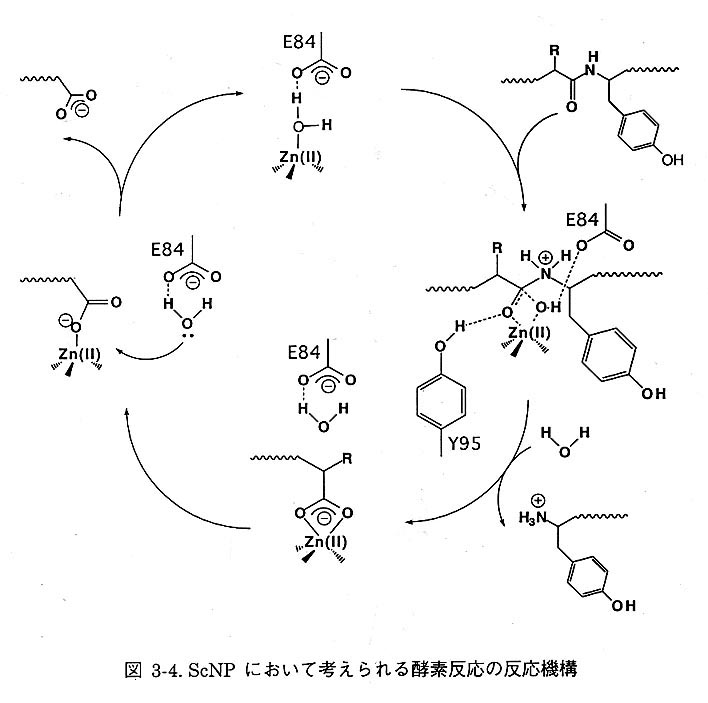
ScNPと同様に4配位型をとるサーモライシンは図3-3の反応機構のうちタイプ3の機構が提唱されている。したがってScNPについても同様に、考えられる反応機構を推測した(図3-4)。まず、E84のCO2-塩基によりZn-OHとなり、それが基質蛋白質の主鎖のカルボニル炭素を求核攻撃する。その際、アミド酸素の亜鉛への配位が考えられるため、中間体として5配位構造をとる。中問体を安定化するために、活性中心近傍に存在するY95がアミド酸素を水素結合により安定化しているというものである。
4. 反応機構解明のための新規な結晶学的手法の開発と適用
より詳細な反応機構の解明を目指して、新規な結晶学的手法の開発と適用を試みた。蛋白質結晶の体積の50%前後は一定の構造を持たない不規則な水分子によって占められている。したがって、結晶状態でも溶液状態と同じように酵素反応が進行すると考えられている。また、この不規則な水分子が存在することによって有機分子と比べて高分解能の結晶構造解析が困難となっている。本研究で取り上げた新規な方法は、結晶中で起こる酵素反応を見るためラウエ法による時問分割構造解析と超精密構造解析である。ラウエ法はミリ秒のオーダーでX線回折強度データを収集してしまう方法であり、超精密解析は通常の蛋白質結晶構造解析では不可能と考えられていた酵素反応が進行する上で重要な水素原子の位置を正確に決定するためのものである。
4-1 ScNP結晶を使ったラウエデータの収集
ラウエ法は一般に単色X線のデータに比べるとそのデータの質が悪いことが指摘されている。その原因として、ラウエ法では低分解能の回折強度が系統的に欠落すること、および放射光の波長分布に対応する波長校正曲線の見積りが困難なことがあげられる。そこで、ScNPの結晶を使ってラウエ法のデータの検討を行った。回折データは筑波高エネルギー物理学研究所・放射光実験施設(BL-18B)において測定した。大型のイメージングプレートを9枚使用し、10msecのX線露光時間で行った。9枚のイメージングプレートを使用したことにより、測定データは全反射の52%まで測定することが可能であった。あわせて、多数の回折点を収集したことにより正確な波長校正曲線を見積もることが可能となり、データの精度を示すRmergeは9%となった。この回折データに対して最小自乗精密化プログラム(PROLSQ)を用いて構造精密化計算を行ったところ、単色のデータと遜色ない電子密度を得ることができた(図4-1)。
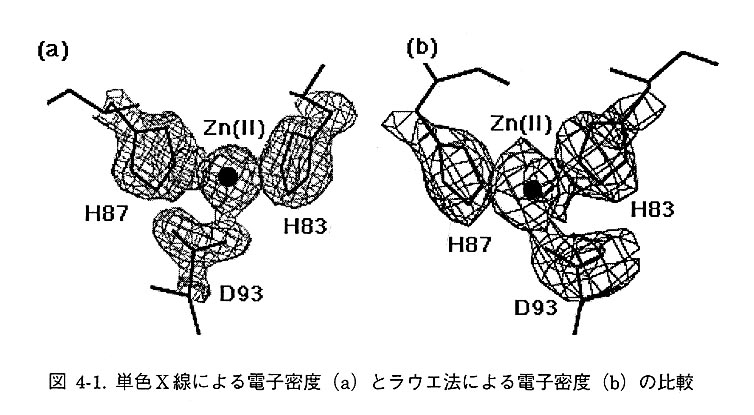
4-2 水素原子の位置を特定するためのX線実験法
有機化合物などのX線結晶解析では、得られた構造の信頼度を示すR-factorは最小自乗計算を使った構造精密化により5%程度になることが知られている。しかし、結晶の格子定数が大きく、結晶中に多くの不規則な水分子を含む蛋白質結晶の場合、測定データの質が低下する。そのため分子中の水素原子の位置を特定することができず、信頼度因R-factorは15%程度にしかならない。したがって、金属を有する蛋白質の正確な配位距離等の情報を得ることができなかった。しかしながら、近年蛋白質の構造を低分子量の化合物と同様に議論するために、高分解能解析の重要性が再認識され始めている。この超精密解析が可能となった要因は、強力なX線源の利用が可能になったことおよび検出器の性能が向上したことがあげられる。
4-3 ScNPの結晶を用いた超高分解能解析
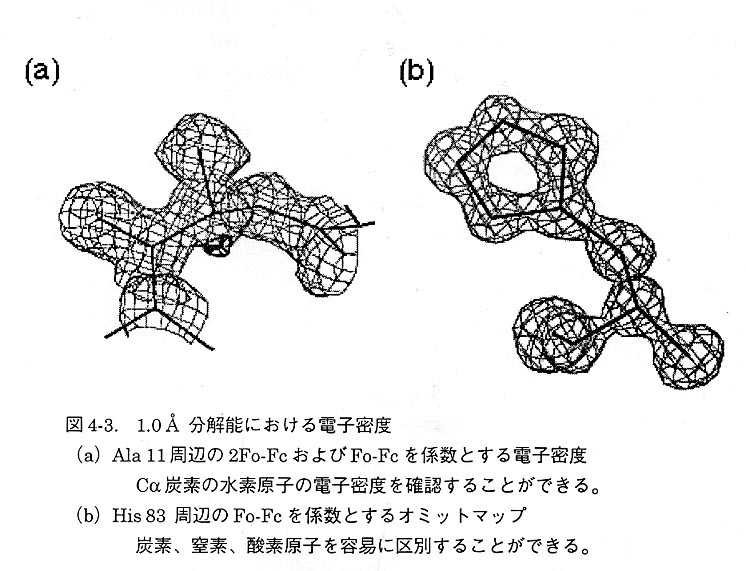
ScNPの結晶はX線に対して非常に安定で、高分解能までの回折強度データを与える。しかし結晶を揮発性のアセトンを沈殿剤とする静置バッチ法で調製するため、操作性の問題から結晶化後アセトンを不揮発性のMPDに置換して回折実験を行っていた。ところが、沈殿剤を置換せずアセトンの揮発しにくい低温状態で回折実験を行うと、1.0Åを超える分解能の回折強度データが測定可能であることがわかった。そこで、X線源に吸収効果の少ない回転対陰極型MoKα線を用い、ワイセンベルグ型の2次元回折計であるR-axisCSを使ってX線回折強度データを収集した。その結果、1.0Å分解能でRmerge 4.4%、completeness 92.7%、最外殻のみでも、Rmerge 23.9%、completeness 78.2%の回折強度データを収集することができた。さらに高エネルギー物理学研究所・放射光実験施設のBL-18Bで波長0.7ÅのX線を用いてデータ測定を行った結果、0.8Å分解能のデータをRmerge 7.5%、completeness 66.5%で収集することができた。等方性温度因子による精密化計算の結果、10-1.0Å分解能で、R=18.5%(Rfree=22.7%)となった。さらに、プログラムSHELXL97を使って異方性温度因子による精密化を行ったところ、R=13.8%となった。差フーリエにより数個の水素原子の位置を確認できた(図4-3(a))。得られた電子密度(図4-3(b))は、Cβ原子を完全な球として判別できる精度であり、窒素原子、炭素原子、酸素原子を容易に区別することができる。現在、さらに精密化を進めているところである。
まとめ
生体高分子の構造と機能との相関は蛋白質工学への有用な知見を与える。また詳細な反応機構の解明は、特異的阻害剤の開発に有用である。本研究では、亜鉛プロテアーゼの構造と機能について酵素学的手法と結晶学的手法を用いて検討した。ラウエ法による時問分割構造解析法の開発および超高分解能における構造精密化に関しては、現在も継続して研究を行っているところである。
ScNPの酵素学研究は大阪大学大学院工学研究科応用生物工学専攻今中研究室との共同研究である。放射光を用いた実験では文部省高エネルギー加速器研究機構物質構造科学研究所の渡邊博士、鈴木博士のお世話になった。高エネルギー物理学研究所の坂部名誉教授には放射光実験全般にわたり貴重な助言をいただいた。最後に深く感謝致します。