
○はじめに
セレン原子の異常分散効果を利用したタンパク質の構造解析は1980年代後半ころになってシンク ロトロン放射光と遺伝子工学の発展に伴ってHendricksonらにより開発され1,2,タンパク質結晶学に 新たな可能性を示しました。メチオニン残基中の硫黄原子をセレン原子に置換したタンパク質を作製 することは現在の遺伝子工学の技術をもってすれば非常に簡単に行うことができます。このセレノメ チオニンを用いた方法では,従来のような結晶を重原子溶液へのソーキングによって重原子置換体を 作製するといった試行錯誤の過程がなく,良質な結晶さえできれば確実に位相情報を与えてくれる結 晶を手に入れることができるのです。また,結晶の同型性に頭を悩ますこともありません。 タンパク質中にメチオニン残基は平均して約58残基に1つの割合いで含有しています。セレンは 周期律表で硫黄の一つ下に位置している元素で,自然界におけるセレンをもつタンパク質の存在も古 くから知られていますが,タンパク質結晶構造解析においてこの元素が使われる理由はおもに2つ挙 げられます。一つはタンパク質中にそれほど無理なくしかも高い置換率で導入できること,そしてセ レン原子の異常分散効果をより利用できる吸収端の波長が構造解析に良く用いられる1Å付近である ことです。当然MAD法を用いるにはシンクロトロン放射光が必要ですが,重原子同型置換体として実 験室系で利用することも十分可能です。
数年ほど前からセレン原子を利用したMAD法による解析の成功例が飛躍的に増大しており,今で は非常に有力な手段として汎用的に構造解析に利用されています,我々もセレンをいれた結晶を積極 的に利用していくことが成功への近道になるのではないでしようか。まずは,結晶を手に入れること から始まりますが,セレノメチオニン置換タンパク質結晶の作製は簡単に言えば次のような順序になります。
1.“メチオニン要求株”でのタンパク質発現系を構築
2.“セレノメチオニン培地”で培養
3. セレノメチオニンタンパク質の特徴に注意しながら精製
4. ふつうの結晶化
5. 祈る
国内の研究室においても最近になって徐々に利用され始めていますが,ここではセレノメチオニンタンパク質の発現,精製,結晶化についてまだ経験のない方々のための解説的なものとして,文献と筆者の研究室での経験に基づいて述べたいと思います。また,ここに述べること以上のノウハウをお持ちの方がいらっしやれば,ぜひ教えていただきたく思います。
○発現
セレノメチオニン置換タンパク質の発現はおもに大腸菌を利用します。動物細胞でも成功した例3 がありますが,今回は大腸菌の場合に限って述べます。
発現に関しては,まず形質転換するわけですが,以下のものが最低必要でしょう。
●大腸菌Met要求株
●目的タンパク質の遺伝子が挿入されているプラスミド
普通の大腸菌はメチオニンを自分で生合成することができるので,セレノメチオニンに置換するた めにはメチオニン要求株(生育にはメチオニンが必須な菌株)を使用しないといけません。現在我々 はB-834(DE3)LysSとDL41の2つの菌株が入手可能です。これらはいずれも染色体上のlacUV5プロモー夕ー下流にT7RNAポリメラーゼ遺伝子が組み込まれてあります。当然プラスミドはこれらの大腸菌 発現系に適したベクターを利用しますが,Novagen の pET システムがよく用いられています。形質転換 を通常の遺伝子操作での実験と同じように行います。
○培養
培養については,もちろんメチオニンフリーの培地で行う必要があります。筆者らはTable 1 に示す 最少培地を用いて大腸菌を培養します。Hendricksonらは1,2,3の代わりにLeMaster培地4と呼ばれ る各種アミノ酸が適度に混合された培地を使用していますが,これとはそれ程大差はないでしよう。 実際にはメチオニンあるいはセレノメチオニン以外のアミノ酸は入れなくても培養可能です。培地組 成のうち、1、3、4だけでも生育可能ですが,とりあえず全部入れてみます。セレノメチオニンは 100mg入りの瓶でsigmaから3万円程度で入手可能です。純水に溶かしてフィルター滅菌後に小分けし たものをストックしておくと便利でしよう。セレノメチオニンの量は暖味になっていますが,その範 囲内で変化させてみても特に菌の生育には大きな差異は見られなかったので,通常25mg/lくらいでや っています。

抗生物質を含んだアガロースプレートから単 ーコロニーを拾ってLB培地で前培養を行います。 通常は本培養を培養フラスコ(1L用)にいれた 上記Table 1 の培地250mlで行っています(Figure 1)。セレンは一般に生物にとって毒性を示すとい うのと,最少培地を使っているせいで大腸菌の生 育は当然通常と比べて悪くなります。Table 1 の 培地に少量のLB培地を混ぜた培地で前培養を行 って菌体をSe-Metに慣らしてあげてからこの培 地に菌を移すというのも1つの方法ですが、それ でもなかなか育ってくれません。いつもは私たち はLB培地で前培養した菌を培地ごと、Se-Met培 地のvolumeに対して1%くらい入れて本培養を しています。タンパク質中のセレノメチオニンの 置換率が問題になりますが,これくらいであれば MADの良質なデータがとれています。培養用フ ラスコにあまり培地を入れ過ぎると酸素が足り ないのか全然育ってくれなくて収量が悪くなる ことが多いです。溶存酸素濃度などがsensitive に収量に効いてくるようです。
吸光度計で濁度をはかってOD=0.5〜0.8くら いになったらIPTGで発現を誘導します。セレノ メチオニンとメチオニンで対照実験を行った例 では,大腸菌の生育は3割程悪くなっています (Figure 2)。でもこれくらいならば問題ないで しよう。しかし,筆者らの経験ではIPTG添加後 は最低10〜12時間は培養しないとたくさん 発現してくれませんでしたので,十分な時間が経 ってから収菌することをお勧めします。とは言っ てもサンプルによって千差万別でしようから,予 備実験をしておくべきかもしれません。培養が終 了したら廃液の処理に注意しましよう。培地にも セレノメチオニンは残っているでしようから,う っかり捨ててしまわないように。
○精製
セレノメチオニンに置換した夕ンパク質の精製は,Nativeのタンパク質のときと全く同じ方法で行 っても問題はないでしよう。経験的なものですが,イオン交換クロマトなどではほぼ同じ条件で溶出 してくると思います。しかし,アフィニティーカラムへの吸着力は弱まるかも知れません。また,重 要なことは溶解度が低下するということです。硫安分画をするような時には条件が違ってくるかも知 れません。また,最も注意を払わなけれぱならないのは,精製の最終段階の濃縮のときでしょう。だ だでさえすぐ沈澱してしまうようなタンパク質はとくに気をつけましよう。すこしでも沈澱を抑える ために透析する溶液の脱気をしたり,EDTAやジチオスレイトール(DTT)などの添加剤をまぜるなど の工夫が必要でしよう。当研究室での例では,うまくいけば分子量1万程度のタンパク質が培地1リ ツトル当たり10mgくらいはとれています。セレンの入ったタンパク質はなにか頭にツーンとくるよう な毒々しい臭いがします。皮膚等につけないように精製中もできるだけ手袋をしましよう。精製後は アミノ酸分析を行うとセレノメチオニンとメチオニンがどのくらいの割合で入っているかがわかるの で確認した方がいいでしよう。
○結晶化
結晶化もNativeの時と同じように行います。濃縮さえ終わればあとは早いうちに結晶化してしまい ましよう。たいていの場合は,すでにNativeのタンパク質の結晶化条件が判っているでしようから, その近傍でやってみることになるのでしようが,先ほども述べたように溶解度が低いので沈澱剤の濃 度をちよっと下げ気味に展開してみた方がいいかも知れません。同じような条件でセレノメチオニン タンパク質の結晶が現れればありがたいです。Native結晶と同型だとさらにうれしい。しかし,もし同 じ条件で出ないのはやはりサンプルの性質がちがってしまったのでしよう。その条件に固執しないで, 他の条件が見つかることを願ってセレノメチオニンタンパク質で新たに結晶化条件のscreeningをしま しよう。新しい条件でできた結晶の方が解きやすい晶系だったり分解能が良かったりというのはいま までに多々あります。ひよっとしたらまさにその結晶1個だけで構造解析ができてしまうかも1?
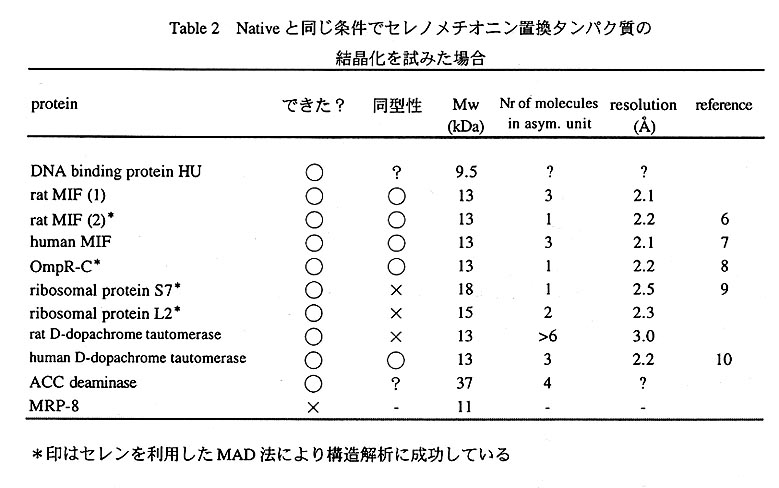
これまでにわたしたちの研究室ではいくつかのタンパク質で,というよりはnative結晶が得られた なら何も考えずにすぐさまセレンをいれた結晶の作製を試みています。Table2にわれわれのセレノメ チオニンタンパク質の結晶化の例を挙げてみます。これをみると,nativeと同じ条件でも高確率でいい 結晶ができていることが分かると思います。MAD法を適用するぶんには必ずしも同型な結晶は必要な いのですが,同型結晶が得られたのは半分くらいです。
参考文献