Rhodopseudomonas palustris由来単量体型チトクロムc'の結晶構造:分子表面の構造と四次構造との相関 柴田直樹、安岡則武 姫路工業大学理学部生命科学科 チトクロムc'は光合成細菌、脱窒素細菌などに存在し、へム c をサブユニッ トあたり1つ含む分子量約14,000のへム蛋白質である。同じへム c をもつチト クロムcとは分子量こそそれほど違わないが、立体構造は全く異なり、さらに5 配位のヘムを持つ点でも異なっている。ヘムの第6配位座は通常空いており、CN-、NO、アルキルイソシアナイドなどの小さな分子に限って配位することが報告され ているが、他のへムタンパク質に比べ親和性は低い。このことから単なる電子伝 達タンパク質ではなく何か別の機能を有する可能性が考えられるが、今のところ このタンパク質の機能についてはまだよくわかっていない。
このタンパク質への興味の対象は2つある。一つには、このタンパク質は他の へムタンパク質には見られない変わった分光学的・磁気的性質を示すことが古く から知られていた。生体内において5配位型のへムは通常高スピン状態になるが、 このタンパク質では高スピン状態に中間スピン状態が混合する混合スピン状態に あることが示唆された。この特殊なスピン状態はチトクロム c' におけるへム近傍 の立体構造の特殊性に起因するものと考えられたが、これに対する回答は初めて チトクロム c' の立体構造がX線結晶構造解析によって明らかにされた時に与えら れた(1)。もう一つは、このタンパク質の四次構造に様々な形態が見られる点で ある。チトクロム c' はホモダイマーとして存在することが知られていた。初めて 立体構造が明らかにされたRhodopseudomonas palustris由来のチトクロム c' (RMCP)や、脱窒素細菌Alcaligenes xylosoxidans (AXCP)及びAlcaligenes denitrificans (ADCP) 由来のチトクロム c' もこのタイプである。しかしながら 特殊な例として、ヘムにリガンドが配位することによりダイマーからモノマーに 解離するもの(Chromatium vinosum, CVCP)、溶液中でモノマーとダイマーが混在 するもの(Rhodobacter capsulatus, RCCP)、完全にモノマーとして存在するもの Rhodopseudomonas palustris, RPCP)があることが報告されている(2)。このよ うな四次構造の相違は必ずしも機能には直接結びついてはいない(3)という見方が一般的ではあるが、もっと大きな視点でタンパク質の四次構造の構築原理という点について興味が持たれる。これまでに7種類のチトクロム c' の立体構造が報告されている(1,3,5-7)が、その内訳はダイマーのものが5種、モノマーに解離するもの1種、モノマーとダイマーが混在するもの1種、という具合になっている。従って、まだモノマー型のチトクロムc’の立体構造については報告がない。我々は以上のような目的で、元Rhodopseudomonas palustris由来のチトクロム c' (RPCP)の立体構造を解析した。
RPCP結晶はシッティングドロップ蒸気拡散法によって調製した。沈殿剤にはPEG5000MMEを用いた。RPCP結晶の回折強度データ測定は高エネルギー加速器研究機構Photon FactoryのBL‐6Aビームラインにおいておこなった。この結晶は双晶になりやすい上に、結晶の質にむらが生じやすい。結局5個の結晶からデータ測定を行い、最も高い分解能を与えた結晶のデータのみを用いた。その結果2.3Å分解能までの回折強度データを収集した。これまでに立体構造が明らかになっているチトクロム c' は立体構造では互いに似ているものの、一次構造の相同性では低い場合がほとんどである。実際、これまで分子置換法による解析の成功率は低く、わずかに2例ほどである。しかしながら、本研究ではモデル分子の候補が多く存在するため分子置換法による解析を行うことにした。その結果最も一次構造の相同性が低いRMCP(相同性18%)を用いた場合にのみ解を求めることが出来た。一次構造のホモロジーが非常に低いにも関わらず、回転関数のピーク、並進サーチの結果は共に上位に見いだされた。構造解析の結果から分かったことだが、一次構造では相同性が低いにもかかわらず、解析に成功したモデルが主鎖の構造では一番近いということが成功の理由であった。得られた初期構造からXPLORとTURBO-FRODOとを用いて精密化を繰り返し行い、最終的に2.3Å分解能での構造が得られた(4)。

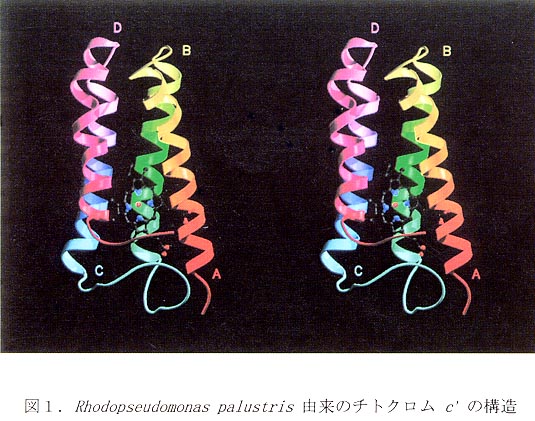
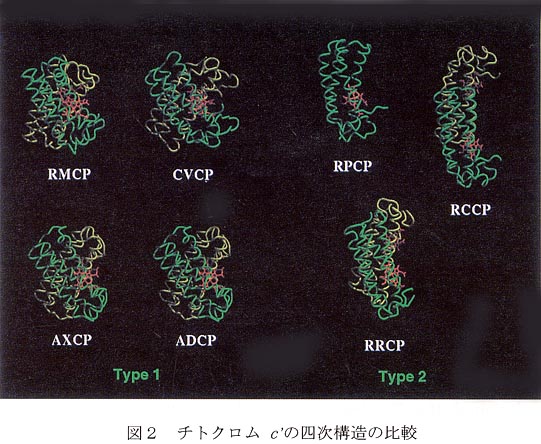
チトクロム c' はFour-helical bundleモチーフ(Helix A-D)を持ち、へムは4本のα一へリックスに囲まれるように存在する(図1)。第6配位座は空いているが、Leu12の側鎖が覆い被さっているため、配位子が結合する場合にはこの部分の構造変化が起こるものと推測される。この様な構造変化はRhodopseudomonas palustrisのチトクロム c' (RCCP)において観測されている(7,8)。各サブユニットはHelix AとHelix Bで形成される面(以下A-B面)で接触することが知られている。図2はチトクロムc’の四次構造を比較したものである。チトクロム c' は少なくとも2つのグループに分けられることが図からわかる。まず、Type1に属するものはすべてダイマー、またはリガンド非存在下でダイマーであり、これらは球状に近くなるようにX型のダイマー構造をとる。一方、Type2ではRPCPの様にモノマーで存在するものや、ダイマー構造をとりうるものでもType 1とは異なり、2つのサブユニットはアンチパラレルに近くなる傾向にある。このような四次構造の相違がなぜ生じるのかさらに検討した。
Type 1のチトクロムc’ではA‐B面に疎水性アミノ酸残基が多数存在している。その数は5〜6個になっている。一方、Type 2に属するRPCPとRCCPでは疎水性残基がわずかに2つしか存在しない。反対に電荷を持つ残基に注目すると、RPCPとRCCPでは7つの電荷を持つ残基が見られるのに対し、Type 1ではわずかに2〜3個しかない。
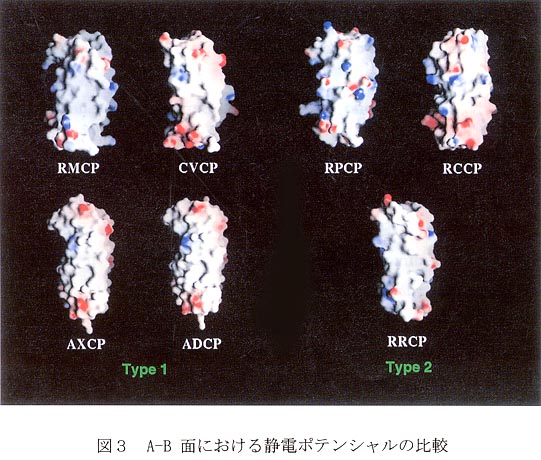
チトクロムc’のA-B面における静電ポテンシヤルを図3に示す。ダイマー型のチトクロムc’では、接触面に疎水性残基が多く存在し、これらの残基による疎水相互作用がダイマー形成に重要であることが報告されている。Type 1に属するものはいずれもこの面の中央付近には電荷がほとんどみられない。一方Type2に属するRPCPとRCCPでは正電荷、負電荷が多く存在する。ただし、両者で電荷分布は全く異なっており、前者ではA-B面のほぼ真ん中に電荷が集中しているのに対し、後者では電荷が面の縁に分散しているという違いが見られた。これは、RPCPはダイマーにはならないため、電荷を持つアミノ酸残基の側鎖が面の中心付近にあってもかまわないが、RCCPでは体積の大きな側鎖がサブユニット会合の妨げにならないよう、中心を避けて縁にのびているものと思われる。RCCPではこれらの電荷を持つアミノ酸残基がサブユニット間で塩橋を形成し、ダイマー形成を促進している。一方、RRCP(5)はType 2に属するが、A一B面において電荷がほとんど見られない。しかしながら、RRCPでは親水性のアミノ酸残基が多く存在し、これらの多くがサブユニット間で水素結合を形成している。その数は他のチトクロムc’に比べ圧倒的に多かった。これはやや特殊な例かもしれない。ダイマー構造もRCCPに比べType 1により近い構造になっている。
以上の結果から、チトクロム c' の四次構造はA-B面に依存し、その疎水性が高いほど球状に近くなることがわかる。別の表現をすれば、塩結合や水素結合がダイマーの構造を球状からより逆平行に近くなるようにしているともいえる。
本研究は本学理学部生命科学科射場聡明君、岬真太郎博士(現、塩野義製薬株式会社)、樋口芳樹博士(現、京都大学大学院理学研究科)、森本幸生博士、アリゾナ大学Terry E.Meyer博士及びMichae1. A. Cusanovich博士、カリフオルニア大学Robert G. Bartsch博士との共同研究によって行われた。本研究を行うにあたり放射光実験においてご助力いただいた高エネルギー加速器研究機構物質科学研究所坂部知平名誉教授、渡邊信久博士、鈴木守博士にお礼申し上げます。
参考文献