- タンパク質精製を行うためのストラテジーは、まず精製工程全体の流れ(骨組み)を把握し、各段階を順を追って決定していきます。
- その流れを図1に示します。


- タンパク質精製を行う場合、同じカラム手法を何回繰り返しても同し性質のものを集めるだけでは分離しているとはいえません。また一回で高純度に単離精製されることもまれで、通常は分離モードの異なる手法を組み合わせて精製工程を決定します。
精製過程はあくまでも試料を得る為の手段であるので作業は最小限に抑えます。
- ①分離精製の目的
- X線回折研究に必要な条件を満たす結晶を得るためには活性のある高純度なタンパク質を10mg以上調製することになります。
また精製時に目的のタンパク質の特性により注意すべき点も最初に設定します。
これらを考慮にいれて精製工程の検討・選択を行います。
- ②分離の要因となるタンパク質の性質
- 目的のタンパク質の性質から精製手法を検討・選択していきます。
- 目的のタンパク質の電気泳動を行うかあるいは構成するアミノ酸配列から計算上の分子量、等電点等を算出します。
- その他目的タンパク質の特性たとえば、280nmの分子吸光係数、塩安定性、疎水性、生物学的特異性(酵素一基質特異性)等も把握しておく必要があります。

- X線回折研究に必要な条件を満たす結晶を得るためには活性のある高純度なタンパク質を10mg以上調製することになります。
- Captureのステップでは多量の粗抽出液からプロテアーゼなどの最も有害な不純物を迅速に除去し、目的のタンパク質を回収、濃縮して安定な状態に移します。
- ここでポイントとなるのは
- ①結合容量
- ②処理量
- ③処理スピード
です。
- ①結合容量
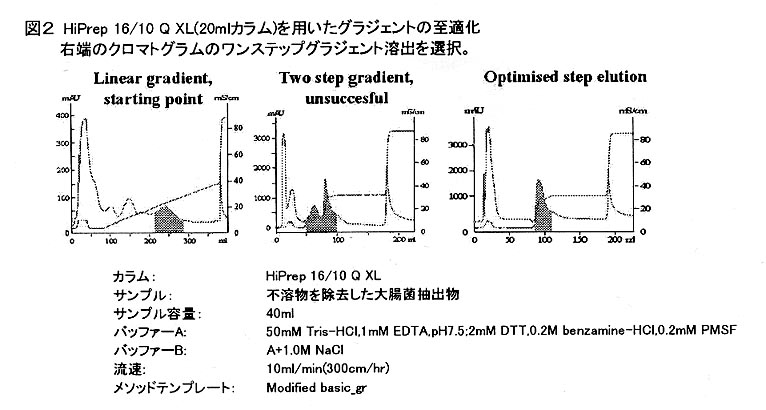
- イオン交換クロマトグラフィーは多種多様な交換体が販売されており、汎用性の高い手法です。イオン交換体の中でも吸着容量が大きく流速特性に優れた担体を用いて回収のステップを行うことが一般的です。
このような高吸着容量担体のメリットは精製物の濃縮・処理時間の短縮・バッファー使用量の低減・更なるスケールアップの可能性・精製装置の小型化があげられます。
- Purificationのステップは様々な精製手法を組み合わせて目的物質の純度を高めてゆく工程です。
ここでポイントとなるのは
・①分離特性
・②回収率
・③操作性
です。作業は最小限に抑え、効率よく純度を高めていくためには分離のモードを変えることが効果的です。
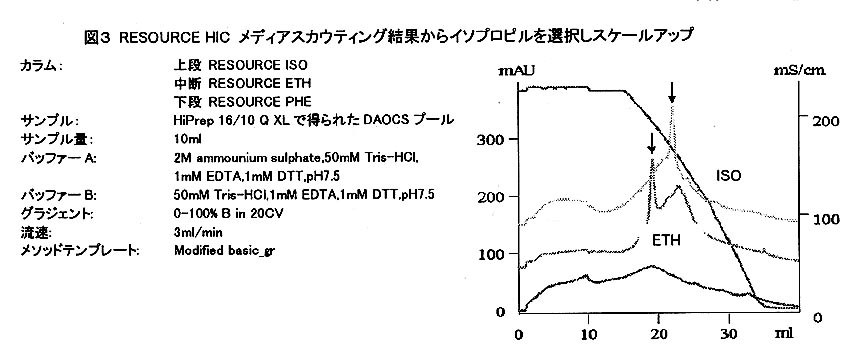
例えばCaptureのステップでイオン交換を用いた場合、目的タンパク質は塩溶出されます。
そこでアフィニティークロマトグラフィーや疎水性クロマトグラフィーなどの高イオン強度で吸着する手法を選択すると分離モードを変えると同時にサンプルの前処理にも手間がかからず効率的に純度を上げていくことができます。 - 目的タンパク質を回収率よく純度を上げていく為に、クロマトグラフィー手法ごとに様々な条件検討を行います。
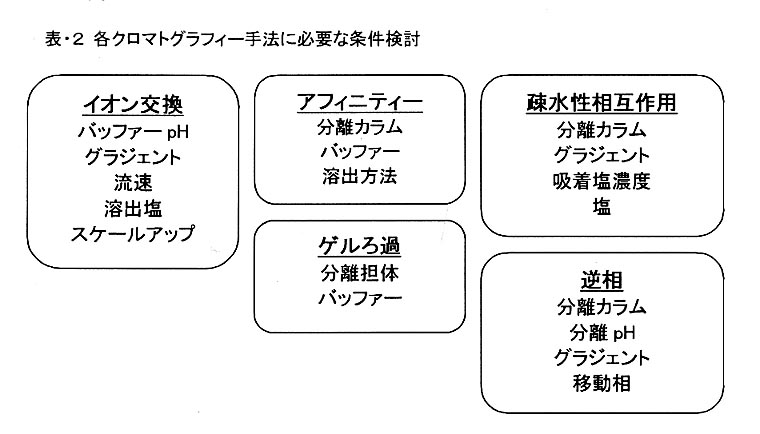
その例を表・2に示します。
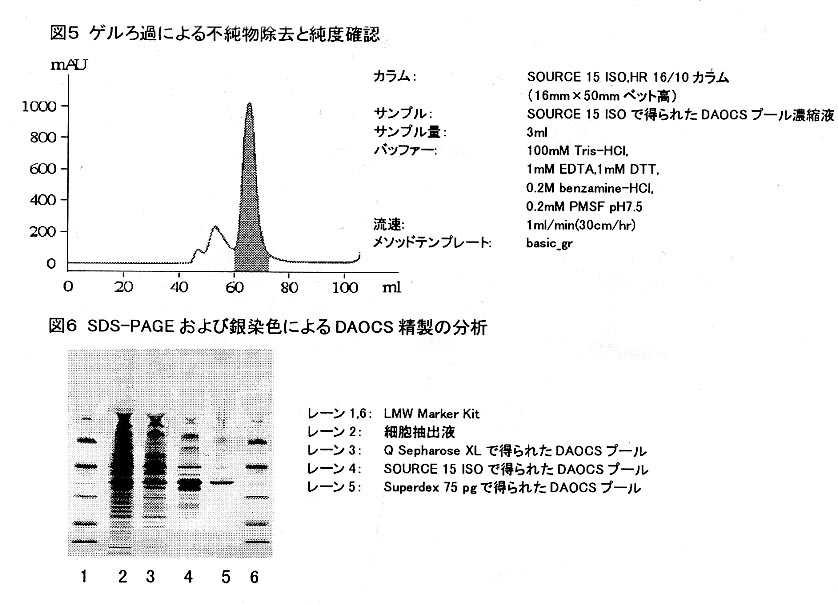
- Polishingのステツプでは目的タンパク質の最終的な磨き上げを行うための工程です。微量に含まれる不純物の除去と純度確認を目的として高分離カラムを使用します。
ここでポイントとなるのは
・分離特性
です。 - ゲルろ過クロマトグラフィーは目的タンパク質をNativeな状態で分離でき、低分子物質の除去、多量体等の分離に有効です。またBuffer交換を兼ねることができるため結晶化の目的には大変効果的です。
最近では分離能・再現性からみて非常に高性能で、なおかつ操作時間の点でも以前に比べ短縮できるようになったカラムが販売されています。目的タンパク質のサイズにより分画範囲の異なる担体を使い分けます。
- このようにタンパク質の精製工程開発には様々なクロマトグラフィー手法の検討、効率的な精製手法の選択、最適分離条件の検討が必要になります。
最近このようなタンパク質精製のストラテジーを迅速に実行していくための機能を兼ね備え高度に自動化したシステムが販売されています。
この後、この最新のタンパク質精製システムを利用した精製工程開発の一例をご紹介いたします。